
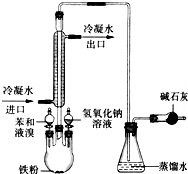
 如图是实验室制取溴苯的装置图.
如图是实验室制取溴苯的装置图.分析 (1)三颈瓶中苯与液溴在Fe作催化剂条件下反应生成溴苯与HBr;
(2)苯与液溴发生取代反应生成的溴化氢易挥发与水蒸气结合形成白雾;
(3)依据冷凝管的作用以及产物有毒回答;
(4)向三颈烧瓶中加入NaOH溶液,与剩余的溴反应生成NaBr、NaBrO与水,防止污染;
(5)反应后,向锥形瓶中滴加硝酸银溶液,HBr与硝酸银反应生成AgBr沉淀,现象是有淡黄色沉淀生成,其作用是检验溴离子,可知发生取代反应.
解答 解:(1)苯与溴在铁做催化剂条件下发生取代反应生成溴苯和溴化氢,方程式:C6H6+Br2$\stackrel{铁}{→}$C6H5Br+HBr;
故答案为:C6H6+Br2$\stackrel{铁}{→}$C6H5Br+HBr;
(2)苯与液溴发生取代反应生成的溴化氢易挥发与水蒸气结合形成白雾;
故答案为:产生白雾;
(3)溴与苯发生取代反应生成溴苯与溴化氢,反应放热溴化氢蒸出,与锥形瓶中的水蒸气结合成白雾,故冷凝管的作用是冷凝回流;反应后的尾气中含有HBr和挥发出的Br2,直接排放会污染大气,碱石灰作用是吸收HBr与Br2,防止污染空气;
故答案为:冷凝回流;吸收HBr与Br2,防止污染空气;
(4)反应结束后,向三颈烧瓶中加入NaOH溶液,与剩余的溴反应,除去杂质;
故答案为:除去溴苯中Br2等杂质;
(5)反应后,向锥形瓶中滴加硝酸银溶液,HBr与硝酸银反应生成AgBr沉淀,现象是有淡黄色沉淀生成,其作用是检验溴离子,可知发生取代反应;
故答案为:AgNO3溶液,产生淡黄色沉淀.
点评 本题考查溴苯的实验室制备,对装置的理解、实验操作等,难度中等,熟悉反应原理及各种物质的化学性质是解题关键.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能用适当的酸碱指示剂来判断 | |
| B. | 参加反应的酸中的H+离子总量和碱中OH-离子总量相等 | |
| C. | 反应混合液的pH=7 | |
| D. | 反应的热效应即为中和热 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质的熔沸点逐渐降低 | B. | 单质的氧化性逐渐增强 | ||
| C. | 相同条件下,单质的密度逐渐变小 | D. | 单质的颜色逐渐加深 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 46g NO2和N2O4混合气体中含有原子数为3NA | |
| B. | 1mol Na2O2和Na2O中离子总数均为2NA | |
| C. | 1mol Mg与足量O2或N2反应均失去2NA个电子 | |
| D. | 标准状况下22.4L H2含有NA个分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,0.1mol Cl2溶于水,转移的电子数目为0.1NA | |
| B. | 标准状况下,2.24L NO和2.24L O2混合后气体分子数为0.15 NA | |
| C. | 加热条件下,1mol Fe投入足量的浓硫酸中,生成NA个SO2分子 | |
| D. | 0.1mol Na2O2与足是的潮湿的二氧化碳反应转移的电子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | O2分子间存在着非极性共价键 | |
| B. | CO2分子内存在着极性共价键 | |
| C. | SO2与H2O反应的产物是离子化合物 | |
| D. | 盐酸中含有H+和Cl-,故HCl为离子化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com