
【题目】某化学兴趣小组为探究二氧化硫的性质,按如图所示装置进行实验。
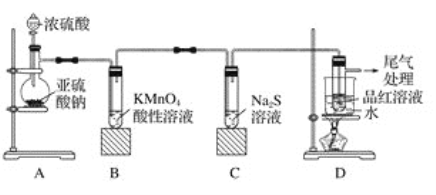
请回答下列问题:
(1)装置A中盛放浓硫酸的仪器名称是__________,反应的化学方程式为_______________。
(2)装置B中的现象是__________________,反应的离子方程式为_________________。
(3)装置C中的现象是______________,该现象说明二氧化硫具有的性质是_____________。
(4)装置D的目的是探究二氧化硫与品红作用的可逆性,写出实验操作及现象_____________。
(5)尾气吸收发生反应的离子方程式为_________________。
【答案】分液漏斗 Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O 溶液由紫色变为无色 5SO2+2![]() +2H2O=5
+2H2O=5![]() +2Mn2++4H+ 溶液中出现淡黄色浑浊 氧化性 品红溶液褪色后,关闭分液漏斗的旋塞,点燃酒精灯加热,溶液恢复红色 SO2+2OH-=SO32-+H2O
+2Mn2++4H+ 溶液中出现淡黄色浑浊 氧化性 品红溶液褪色后,关闭分液漏斗的旋塞,点燃酒精灯加热,溶液恢复红色 SO2+2OH-=SO32-+H2O
【解析】
(1)根据装置结构判断其名称;
(2)根据二氧化硫能被酸性高锰酸钾溶液氧化分析;
(3)根据二氧化硫能把S2-氧化成S单质进行分析;
(4)根据生成物质不稳定分析解答;
(5)二氧化硫为酸性氧化物进行分析。
(1)根据装置图,盛放浓硫酸的仪器是分液漏斗;其中发生反应的化学方程式为Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O;
(2)SO2具有还原性,能被MnO4-氧化成SO2,本身被还原成Mn2+,因此装置B中的现象是溶液由紫(红)色变为无色,或紫(红)色褪去;离子方程式为2MnO4-+5SO2+2H2O=5SO42-+2Mn2++4H+;
(3)SO2与S2-发生氧化还原反应,得到S单质,因此装置C中现象是无色溶液出现淡黄色浑浊;反应SO2中S的化合价由+4价→0价,化合价降低,体现SO2的氧化性;
(4)二氧化硫的漂白是不稳定的,因此品红溶液褪色后,关闭分液漏斗的旋塞,点燃酒精灯加热,溶液恢复红色,可以证明SO2与品红作用的可逆性;
(5)SO2有毒,污染环境,尾气中的SO2必须除去,SO2属于酸性氧化物,尾气用NaOH溶液吸收,以防止污染环境,发生的离子方程式为SO2+2OH-=SO32-+H2O。


科目:高中化学 来源: 题型:
【题目】实验室探究SO2性质的装置如图所示。下列说法错误的是( )
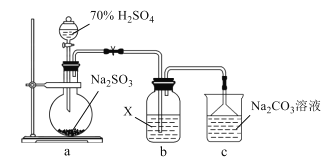
A.装置a中的反应可用铜片和浓硫酸代替
B.若X为H2S溶液,装置b中产生淡黄色沉淀
C.若X为含HCl、BaCl2的FeCl3溶液,装置b中产生白色沉淀
D.反应后装置c中溶液的pH降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3等杂质)中提取氧化铝的两种工艺流程如图:
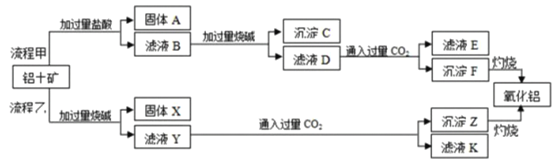
请回答下列问题:
(1)固体A的主要成分是___(写名称)。
(2)铝土矿与过量盐酸反应的离子方程式为___、___。
(3)电解熔融氧化铝可制得单质铝,写出该反应化学方程式____;已知氯化铝的熔点更低,工业中为何不用电解熔融氯化铝的方法制备该单质___。
(4)得到的单质铝可以跟强碱溶液放出氢气,每转移6.02×1025个电子,实际上参与反应的氧化剂为___mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A转化为C和D分步进行:①A(g)![]() B(g)+2D(g)②B(g)
B(g)+2D(g)②B(g)![]() C(g)+D(g),其反应过程能量如图所示,下列说法正确的是( )
C(g)+D(g),其反应过程能量如图所示,下列说法正确的是( )
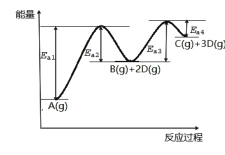
A.1molA(g)的能量低于1molB(g)的能量
B.B(g)![]() C(g)+D(g) ΔH=Ea4-Ea3
C(g)+D(g) ΔH=Ea4-Ea3
C.断裂1molA(g)化学键吸收的热量小于形成1molC(g)和3molD(g)化学键所放出的热量
D.反应过程中,由于Ea3<Ea1,反应②速率大于反应①,气体B很难大量积累
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可用如下方法制取Cl2:
①MnO2 +4HCl(浓)![]() Cl2↑+ MnCl2+ 2H2O
Cl2↑+ MnCl2+ 2H2O
②KClO3+6HCl(浓)=3Cl2↑+KCl+3H2O
③2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
根据相关信息,回答下列问题:
(1)在反应①中,HCl表现的性质有______、________。
(2)若反应①中有0.1mol的氧化剂被还原,则被氧化的物质的物质的量为____。
(3)将(2)生成的氯气与0.2mol H2完全反应,将产物溶于水配成100mL溶液,此溶液的物质的量浓度为_______。
(4)若要制得相同质量的氯气,①②③三个反应中电子转移的数目之比为____。
(5)已知反应4HCl(g)+O2  2Cl2+2H2O(g),该反应也能制得氯气,则MnO2、O2、KMnO4三种物质氧化性由强到弱的顺序为_______。
2Cl2+2H2O(g),该反应也能制得氯气,则MnO2、O2、KMnO4三种物质氧化性由强到弱的顺序为_______。
(6)将不纯的NaOH样品2.50 g(样品含少量Na2CO3和水),放入50.0 mL 2.00mol/L盐酸中,充分反应后,溶液呈酸性,中和多余的酸又用去40.0 mL 1.00 mol/L的NaOH溶液。蒸发中和后的溶液,最终得到固体的质量为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,不能用勒夏特列原理解释的是
A. 红棕色的NO2,加压后颜色先变深后变浅
B. 高压比常压有利于合成SO3的反应
C. 加入催化剂有利于氨的合成
D. 工业制取金属钾Na(l)+KCl(l)![]() NaCl(l)+K(g)选取适宜的温度,使K变成蒸气从反应混合物中分离出来
NaCl(l)+K(g)选取适宜的温度,使K变成蒸气从反应混合物中分离出来
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应:A(g)+B(g) ![]() C(s)+2D(g)的ΔH>0,下图所示为正逆反应速率(v)与时间(t)的关系,如果在t1时刻改变以下条件:①加入A;②加入催化剂;③加压;④升温;⑤移走C,符合图示的条件是( )。
C(s)+2D(g)的ΔH>0,下图所示为正逆反应速率(v)与时间(t)的关系,如果在t1时刻改变以下条件:①加入A;②加入催化剂;③加压;④升温;⑤移走C,符合图示的条件是( )。
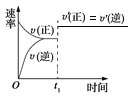
A. ②③B. ①②C. ③④D. ④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学利用如图所示装置探究二氧化硫气体的性质。
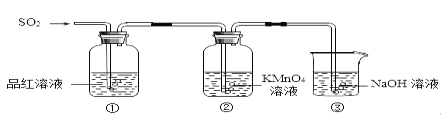
请回答:
(1)实验室用铜和浓硫酸共热制取二氧化硫,反应的化学方程式是_________。
(2)当观察到②中溶液颜色变浅时,①中的现象是_________。
(3)装置③的作用是________。
(4)①、②中的现象说明二氧化硫具有的性质是_________。
(5)③中涉及的化学反应方程式是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室利用如下装置制取氯化铁粉末,已知氯化铁粉末很容易吸水生成结晶化合物FeCl3+6H2O = FeCl3·6H2O
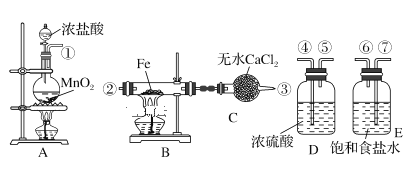
(1)按照气体流向从左到右顺序连接仪器应是(填仪器接口顺序,各接口序号间用“—”连接):①—_____。
(2)烧瓶A中反应的离子方程式为________,其中,氧化剂是________(填物质名称)。
(3)B中反应的化学方程式是_____________。
(4)装置C的作用是_______________。
(5)A、B中的酒精灯应先点燃____处(填“A”或“B”)的酒精灯,理由是__________。
(6)小明同学认为这套实验装置不完整,还须补充________装置。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com