
根据原子结构及元素周期律的知识,下列推断正确的是( )
A.同主族元素含氧酸的酸性随核电荷数的增加而减弱
B.Cl-、S2-、Ca2+、K+半径逐渐减小
C.核外电子排布相同的微粒化学性质也相同
D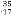 Cl与
Cl与 Cl得电子能力相同
Cl得电子能力相同
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2015-2016学年河北省石家庄市高一下期中理科化学试卷(解析版) 题型:选择题
用铂电极电解CuSO4溶液,当铜离子浓度降至一半时,停止通电,若使CuSO4溶液恢复至原来的浓度,应加入的物质是
A.CuSO4 B. CuSO4·5H2O C.CuO D.Cu(OH)2
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江省伊春市高一下期中化学试卷(解析版) 题型:选择题
下列说法正确的是( )
A.现在的《元素周期表》是俄国化学家门捷列夫1869年绘制的版本
B.在周期表中,把电子层数相同的元素排成一横行,称为主族
C.元素周期表中,总共有18个纵行,18个族
D.第ⅠA族的元素又称为碱金属元素(除了H),第ⅦA族的元素又称为卤族元素
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江省高一下期中化学试卷(解析版) 题型:填空题
为了清理路面积雪,人们常使用一种融雪剂,其主要成分的化学式为XY2,X、Y均为周期表前20号元素,其阳离子和阴离子的电子层结构相同,且1 mol XY2含有54 mol电子。
(1)该融雪剂的化学式是__________,该物质中化学键类型是________,电子式是_______
(2)元素D、E原子的最外层电子数是其电子层数的2倍,D与Y相邻,则D的离子结构示意图是______;D与E能形成一种结构类似于CO2的三原子分子,且每个原子均达到了8e-稳定结构,该分子的电子式为______________,化学键类型为________(填“离子键”、“非极性共价键”或“极性共价键”)。
(3)W是与D同主族的短周期元素,Z是第三周期金属性最强的元素,Z的单质在W的常见单质中反应时有两种产物:不加热时生成___________(填化学式,下空相同),加热时生成_____________,其化学键类型为____________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江省高一下期中化学试卷(解析版) 题型:选择题
燃料电池是燃料(如CO、H2、CH4等)跟氧气(或空气)起反应将化学能转变为电能的装置,若电 解质溶液是强碱溶液,下面关于甲烷燃料电池的说法正确的是( )
A.负极反应式:O2+2H2O+4e-===4OH-
B.负极反应式:CH4+8OH--8e-===CO2+6H2O
C.随着放电的进行,溶液中的氢氧根离子浓度不变
D.放电时溶液中的阴离子向负极移动
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江省高一下期中化学试卷(解析版) 题型:选择题
下列关于元素周期表和元素周期律的说法不正确的是( )
A.从氟到碘,其氢化物的稳定性逐渐减弱
B.因为铝原子比钠原子失去电子数目多,所以铝比钠的还原性强
C.第三周期从钠到氯,最高价氧化物对应的水化物碱性逐渐减弱,酸性逐渐增强
D.氧与硫为同主族元素,氧比硫的原子半径小,氧比硫的非金属性强
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北省枣阳市高一5月月考化学试卷(解析版) 题型:推断题
(1)某有机物A由C、H、O三种元素组成,90克A完全燃烧可生成132克CO2和54克H2O。
试求:
① 该有机物的最简式 。
② 若符合该最简式的A物质可能不止一种,则它们之间的关系 (填序号)
A.一定互为同系物 B.一定互为同分异构体
C.等质量的它们完全燃烧耗氧量相同 D.等物质的量的它们完全燃烧耗氧量相同
③ 若A的相对分子质量为180,每个碳原子上最多只有一个官能团,能发生银镜反应,也能发
生酯化反应,且所有碳原子在同一链上,则A的结构简式为 。
(2)有机物A(C10H20O2)具有兰花香味,可用作香皂、洗发香波的芳香赋予剂。
已知:

ⅰ.B分子中没有支链。
ⅱ.D能与碳酸氢钠溶液反应放出二氧化碳。ⅲ.D、E互为具有相同官能团的同分异构体。E分子烃基上的氢若被Cl取代,其一氯代物只有一种。ⅳ.F可以使溴的四氯化碳溶液褪色。
① B可以发生的反应有 (选填序号)。
a.取代反应 b.消去反应 c.加聚反应 d.氧化反应
② D、F分子所含的官能团的名称依次是 、 。
③ 写出与D、E具有相同官能团的一种同分异构体的结构简式__________________。
④ 写出B和E反应生成A的化学方程式是: 。
⑤ 写出C与银氨溶液反应的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北省枣阳市高一5月月考化学试卷(解析版) 题型:选择题
对于反应中的能量变化,表述正确的是
A.放热反应中,反应物的总能量大于生成物的总能量
B.断开化学键的过程会放出能量
C.加热才能发生的反应一定是吸热反应
D.氧化反应均为吸热反应
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北省枣阳市高二5月月考化学试卷(解析版) 题型:实验题
工业上电解氧化铝要求其纯度不得低于98.2%,而天然铝土矿的氧化铝含量为50%~70%,杂质主要为SiO2、Fe2O3、CaO、MgO、Na2O等。工业生产铝锭的工艺流程示意图如下:
部分氢氧化物沉淀的pH如下表
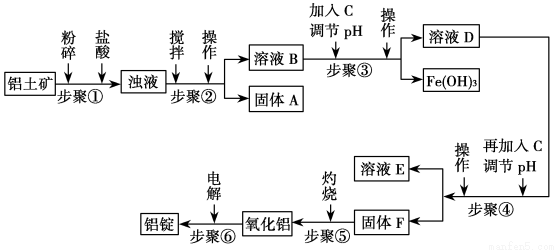
沉淀物 | Al(OH)3 | Fe(OH)3 | Mg(OH2 |
开始沉淀pH (离子初始浓度0.01 mol/L) | 4.3 | 2.3 | 10.4 |
完全沉淀pH (离子浓度<10-5 mol/L) | 5.2 | 4.1 | 12.4 |
请回答下列问题:
(1)加入盐酸时,氧化铝发生反应的离子方程式为_________。
(2)实验室进行步骤②的操作名称为________,其使用到的玻璃仪器是 。
(3)固体A的化学式为_______,物质C的化学式为_______;溶液中的Na+、Ca2+、Mg2+是在步骤________(填序号)中分离出去的。
(4)步骤③调节pH的数值范围为_______,步骤④调节pH的数值范围为_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com