
| 化学键 | C-C | C-H | H-H | C-O | C≡O | H-O |
| 键能/kJ•mol-1 | 348 | 413 | 436 | 358 | 1072 | 463 |
 或
或
分析 (1)依据化学反应焓变=反应物键能总和-生成物键能总和计算,标注物质聚集状态和对应反应的焓变写出热化学方程式;
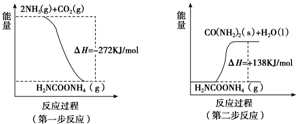
(1)据图写出各自的热化学方程式,①2NH3(g)+CO2(g)?H2NCOONH4(g)△H1=-272KJ/mol,②H2NCOONH4(g)?H2O(l)+H2NCONH2(s)△H2=+138KJ/mol,
再根据盖斯定律,由①+②得出正确结论;
(3)2-丙醇在浓硫酸作用下发生消去反应生成丙烯;
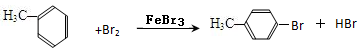
(4)甲苯在铁的催化作用下与液溴主要发生苯环上甲基的邻、对位取代反应;
(5)Na2S2O3与稀硫酸发生氧化还原反应生成S、二氧化硫、硫酸钠和水.
解答 解:(1)CO(g)+2H2(g)?CH3OH (g),反应的焓变=反应物总键能之和-生成物总键能之和,故△H=1072KJ/mol+2×436KJ/mol-(3×413KJ/mol+358KJ/mol+463KJ/mol)=-116 kJ•mol-1,故热化学方程式为:CO(g)+2H2(g)?CH3OH (g)△H=-116 kJ•mol-1,
故答案为:CO(g)+2H2(g)?CH3OH (g)△H=-116 kJ•mol-1;
(2)①2NH3(g)+CO2(g)?H2NCOONH4(g)△H1=-272KJ/mol,
②H2NCOONH4(g)?H2O(l)+H2NCONH2(s)△H2=+138KJ/mol,
根据盖斯定律,由①+②得,2NH3(g)+CO2(g)?H2O(l)+H2NCONH2(s)△H=(-272KJ/mol)+(+138KJ/mol)=-134kJ•mol-1;
故答案为:2NH3(g)+CO2(g)?H2O(l)+H2NCONH2(s)△H=-134kJ•mol-1;
(3)2-丙醇在浓硫酸作用下发生消去反应,CH3CH(OH)CH3$→_{△}^{浓硫酸}$CH3CH=CH2↑+H2O,故答案为:CH3CH(OH)CH3$→_{△}^{浓硫酸}$CH3CH=CH2↑+H2O;
(4)甲苯在铁的催化作用下与液溴主要发生苯环上甲基的邻、对位取代反应,化学方程式为: 或
或 ;
;
故答案为: 或
或 ;
;
(5)Na2S2O3与稀硫酸发生氧化还原反应生成S、二氧化硫、硫酸钠和水,离子方程式为S2O32-+2H+=SO2↑+S↓+H2O,故答案为:S2O32-+2H+=SO2↑+S↓+H2O.
点评 本题考查热化学方程式的相关计算及书写、有机反应方程式的书写及氧化还原反应离子方程式的书写,难度中等.


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:选择题
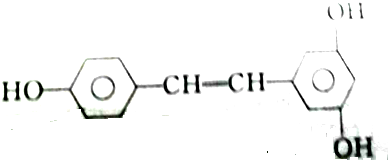
| A. | 2mol、2mol、6mol | B. | 5mol、2mol、6mol | C. | 4mol、2mol、5mol | D. | 3mol、2mol、6mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
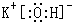 (填写电子式);
(填写电子式);查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液pH由大变小 | B. | 负极附近Zn2+浓度逐渐增大 | ||
| C. | H+向负极移动 | D. | 溶液中H2SO4的浓度不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  铁丝的析氢腐蚀实验 | B. | 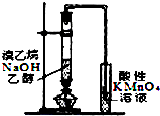 检验该反应的有机产物 | ||
| C. | 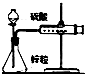 结合秒表测量锌与硫酸的反应速率 | D. | 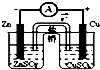 验证化学能转化为电能 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1的HNO2溶液中[H+]约为0.01 mol•L-1 | |
| B. | 用HNO2溶液做导电实验,灯泡很暗 | |
| C. | HNO2溶液不与Na2SO4溶液反应 | |
| D. | HNO2能与NaOH溶液发生中和反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为了使过滤速度加快,可用玻璃棒在过滤器中轻轻搅拌,加速液体流动 | |
| B. | 燃着的酒精灯打翻失火,应立即用水浇灭 | |
| C. | 为加速固体物质的溶解,可采用粉碎、振荡、搅拌、加热等方法 | |
| D. | 为增大气体物质的溶解度,常采用搅拌、加热等措施 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com