
【题目】已知反应:CH2=CHCH3(g)+Cl2(g)![]() CH2=CHCH2Cl(g)+HCl(g)。在一定压强下,按
CH2=CHCH2Cl(g)+HCl(g)。在一定压强下,按![]() 向密闭容器中充入氯气与丙烯。图甲表示平衡时,丙烯的体积分数(
向密闭容器中充入氯气与丙烯。图甲表示平衡时,丙烯的体积分数(![]() )与温度(T)、
)与温度(T)、![]() 的关系,图乙表示反应的平衡常数K与温度T的关系。则下列说法正确的是
的关系,图乙表示反应的平衡常数K与温度T的关系。则下列说法正确的是

A. 图甲中![]()
B. 若在恒容绝热装置中进行上述反应,达到平衡时,装置内的气体压强将不变
C. 温度T1、![]() , Cl2的转化率约为33.3%
, Cl2的转化率约为33.3%
D. 图乙中,线A表示正反应的平衡常数
【答案】C
【解析】
A.ω增大,CH2=CHCH3的转化率增大,则φ减小,由上述分析可知:ω2>ω1,则ω1<1,故A错误;
B.该反应在反应前后气体分子数不变,根据图甲升高温度丙烯的体积分数增大,即升高温度平衡逆向移动,正反应放热,在恒容绝热装置中进行题述反应,体系内温度升高,根据PV=nRT,达到平衡时,装置内的气体压强将增大,故B错误;
C.由图乙可知,T1时平衡常数为1,设起始时CH2=CHCH3和Cl2的物质的量分别为amol和2amol,达到平衡时转化的Cl2的物质的量为xmol,根据三段式进行计算:
CH2=CHCH3(g)+Cl2(g) ![]() CH2=CHCH2Cl(g)+HCl(g)
CH2=CHCH2Cl(g)+HCl(g)
起始(mol) a 2a 0 0
转化(mol) x x x x
平衡(mol) a-x 2a-x x x
则(![]() )2÷(
)2÷(![]() ×
×![]() )=1,解得x=2/3a,则Cl2的转化率2/3a÷2a×100%=33.3%,
)=1,解得x=2/3a,则Cl2的转化率2/3a÷2a×100%=33.3%,
故C正确;
D.由图甲可知,ω一定时,温度升高,φ增大,说明正反应是放热反应,故温度升高,正反应平衡常数减小,故图乙中,线A表示逆反应的平衡常数,故D错误。
故选C。


科目:高中化学 来源: 题型:
【题目】硫酸亚铁铵[(NH4)2Fe(SO4)2]是分析化学中的重要试剂,在不同温度下加热分解产物不同。设计如图实验装置(夹持装置略去),在500℃时隔绝空气加热A中的硫酸亚铁铵至分解完全。确定分解产物的成分。

(1)B装置的作用是__________。
(2)实验中,观察到C中无明显现象,D中有白色沉淀生成,可确定产物中定有______气体产生,写出D中发生反应的离子方程式__________。若去掉C,是否能得出同样结论并解释其原因_____________。
(3)A中固体完全分解后变为红宗色粉末,某同学设计实验验证固体残留物仅为Fe2O3.而不含FeO。请完成表内容。(试剂,仅然和用品自选)
实验步骤 | 预期现象 | 结论 |
取少量A中残留物于试管中,加入适量稀硫酸,充分振荡使其完全溶解:_________ | ___________ | 固体残留物仅为Fe2O3 |
(4)E中收集到的气体只有N2,其物质的量为xmol,固体残留物刚体死目物Fe2O3的物质的量为ymol,D中沉淀物质的量为zmol,根据氧化还原反应的基本规律,x、y和z应满足的关系为________。
(5)结合上述实验现象和相关数据的分析。写出硫酸亚铁铵在500℃时隔绝空气加热完全分解的化学方程式:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯是工业上重要的原料,是合成有机物的中间体。
2NO(g)+Cl2(g)![]() 2ClNO(g) △H<0
2ClNO(g) △H<0
(1)在恒温条件下,向2L恒容密闭容器中加入0.2molNO和0.1molCl2,10min时反应达到平衡。测得10min内v(ClNO)=7.5×10-3mol·L-1·min-1 ,则平衡后NO的转化率α1=_____________。其它条件保持不变,反应在恒压条件下进行,平衡时NO的转化率α2________α1(填“>”“<”或“=”)。
(2)若使反应2NO(g)+Cl2(g)![]() 2ClNO(g) 的平衡常数增大,可采用的措施是___________。
2ClNO(g) 的平衡常数增大,可采用的措施是___________。
(3)将NO与Cl2按物质的量之比2∶1充入一绝热密闭容器中,发生反应:2NO(g)+Cl2(g)![]() 2ClNO △H<0,实验测得NO的转化率α(NO)随时间的变化经如图所示。NO(g)的转化率α(NO)在t2~t3时间段内降低的原因是______________________________。
2ClNO △H<0,实验测得NO的转化率α(NO)随时间的变化经如图所示。NO(g)的转化率α(NO)在t2~t3时间段内降低的原因是______________________________。

(4)在其他条件相同时,向五个恒温的密闭容器中分别充入1molCl2与2molNO,发生反应:2NO(g)+Cl2(g)![]() 2ClNO(g) △H< 0,部分反应条件及平衡时ClNO的含量如下表所示:
2ClNO(g) △H< 0,部分反应条件及平衡时ClNO的含量如下表所示:
容器编号 | 温度/℃ | 容器体积/L | 平衡时ClNO含量(占比) |
Ⅰ | T1 | 2 | 2/3 |
Ⅱ | T2=T1 | 3 | W2 |
Ⅲ | T3>T1 | V3 | 2/3 |
Ⅳ | T4 | V4 | W4 |
Ⅴ | T5 | V5 | W5 |
①V3________2 (填写“大于”、“小于”或“等于”);
②容器Ⅱ中化学平衡常数K=_________;
③容器Ⅳ、容器Ⅴ分别与容器Ⅰ相比实验条件不同,反应体系总压强随时间的变化如图所示。与容器Ⅰ相比,容器Ⅳ改变的实验条件是_____________________;容器Ⅴ与容器Ⅰ的体积不同,则容器Ⅴ中反应达到平衡时气体总压强(P )的范围是________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨为重要化工原料,有广泛用途。
(1)合成氨中的氢气可由下列反应制取:
a.CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H=+216.4KJ/mol
CO(g)+3H2(g) △H=+216.4KJ/mol
b.CO(g)+H2O(g)![]() CO2(g)+H2(g) △H=-41.2kJ/mol
CO2(g)+H2(g) △H=-41.2kJ/mol
则反应CH4(g)+2H2O(g)![]() CO2(g)+4H2(g) △H=______。
CO2(g)+4H2(g) △H=______。
(2)起始时投入氮气和氢气分别为1mol、3mol,在不同温度和压强下合成氨。平衡时混合物中氨的体积分数与温度关系如图。

①恒压时,反应一定达到平衡状态的标志是______(填序号):
A.N2和H2的转化率相等 B.反应体系密度保持不变
C.![]() 的比值为3:2 D.
的比值为3:2 D.![]() =2
=2
②P1______P2(填“>”、“<”、“=”,下同):反应平衡常数:B点______D点;
③C点H2的转化率______;(数值保留0.1%)在A、B两点条件下,该反应从开始到平衡时生成氢气平均速率:v(A)______v(B)(填“>”、“<”、“=”)。
(3)已知25℃时由Na2SO3和NaHSO3形成的混合溶液恰好呈中性,则该混合溶液中各离子浓度的大小顺序为______________(已知25℃时,H2SO3的电离平衡常数Ka1=1×10-2,Ka2=1×10-7)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 用牺牲阳极的阴极保护法保护船舶时,将船舶与石墨相连
B. 往含硫酸的淀粉水解液中,先加氢氧化钠溶液,再加碘水,检验淀粉是否水解完全
C. 反应3Si(s)+2N2(g)=Si3N4(s)能自发进行,则该反应的△H<0
D. 已知BaSO4的Ksp= (Ba2+ )·c(SO42-),所以BaSO4在硫酸钠溶液中溶解达到饱和时有c(Ba2+)=c(SO42-)=![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NO2是大气污染物,但只要合理利用也是重要的资源。回答下列问题:
(1)NO2可以被NaOH溶液捕获生成两种钠盐,溶液呈碱性,写出反应的化学方程式______________,已知常温下,HNO2的电离平衡常数为Ka=5.0×10-4,则0.1mo/L NaNO2中c(OH-)=_____________(已知![]() )
)
(2)2NO(g)+O2(g)![]() 2NO2(g)的反应历程分两步,反应情况如下表:
2NO2(g)的反应历程分两步,反应情况如下表:
反应 | 速率表达式 | 反应热 |
反应I:2NO(g) |
| △H1<0 |
反应II:N2O2(g)+O2(g) |
| △H2<0 |
反应2NO(g)+O2(g) ![]() 2NO2(g)的△H______(用△H1、△H2表示)。一定温度下,反应2NO(g)+O2(g)
2NO2(g)的△H______(用△H1、△H2表示)。一定温度下,反应2NO(g)+O2(g)![]() 2NO2(g)达到平衡状态,若升高温度,K将____(填“增大”、“减小”或“不变”),平衡常数的表达式K=____(用
2NO2(g)达到平衡状态,若升高温度,K将____(填“增大”、“减小”或“不变”),平衡常数的表达式K=____(用![]() 、
、![]() 、
、![]() 、
、![]() 表示)
表示)
(3)反应N2O4(g) ![]() 2NO2(g),在一定条件下N2O4与NO2的消耗速率与自身压强关系为:υ(N2O4)=k1· p(N2O4),υ(NO2)=k2· p(NO2),其中
2NO2(g),在一定条件下N2O4与NO2的消耗速率与自身压强关系为:υ(N2O4)=k1· p(N2O4),υ(NO2)=k2· p(NO2),其中![]() 、
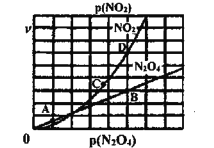
、![]() 是与温度有关的常数。一定温度下,相应的速率与压强关系如图所示,在图中标出的点中,能表示该反应达到平衡状态对应的两个点是___________
是与温度有关的常数。一定温度下,相应的速率与压强关系如图所示,在图中标出的点中,能表示该反应达到平衡状态对应的两个点是___________
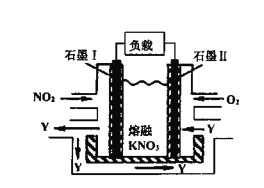
(4)NO2、O2和熔融KNO3可制作燃料电池,其原理如图,该电池在使用过程中石墨I电极上生成氧化物Y,Y可循环使用。Y的化学式为____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,体积固定的密闭容器中发生可逆反应4HCl(g)+O2(g)=2H2O(g)+2Cl2(g)下列能说明反应已经达到平衡状态的是( )
A.混合气体的密度保持不变
B.混合气体的平均相对分子质量保持不变
C.断开4molH﹣Cl键的同时,生成4molH﹣O键
D.HCl、O2、H2O、Cl2四种气体的物质的量之比为4:1:2:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生为了探究锌与盐酸反应过程中的速率变化,他在100mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(表中气体体积为累计值,且已转化为标准状况):
时间(min) | 1 | 2 | 3 | 4 | 5 |
氢气体积(mL) | 50 | 120 | 232 | 290 | 310 |
①哪一时间段(指0~1、1~2、2~3、3~4、4~5min)反应速率最大_____min,原因是_________________.
②哪一段时段的反应速率最小_____min,原因是_____________.
③求2~3分钟时间段以盐酸的浓度变化来表示的该反应速率_____________(设溶液体积不变)
④如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,他在盐酸中分别加入等体积的下列溶液:
A.蒸馏水;B.NaCl溶液;C.NaNO3溶液;D.CuSO4溶液;E.Na2CO3溶液,你认为可行的是_____.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语书写正确的是( )
A. 铁粉投入到NaHSO4溶液中的离子方程式:Fe+2HSO4—=Fe2++H2↑+ 2SO42—
B. HS-的电离方程式: HS-+H2O=== H3O++S2-
C. 液氨也可像水一样发生自偶电离:2NH3![]() NH4++NH2—
NH4++NH2—
D. 双氧水具有弱酸性,其电离方程式: H2O2![]() 2H++O22-
2H++O22-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com