
| A. | ① | B. | ② | C. | ③ | D. | ④ |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
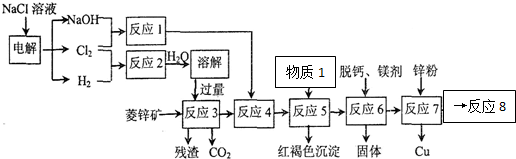
| 离子 | 开始沉淀时的PH | 完全沉淀时的PH |
| Fe3+ | 1.9 | 3.2 |
| Fe2+ | 7.5 | 9.7 |
| Zn2+ | 6.4 | 8.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
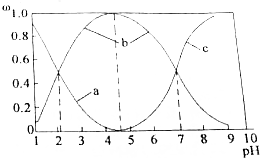 氯化亚砜(SOCl2)液体是一种重要的有机合成试剂,还用于农药、医药、燃料的生产等.回答下列问题:
氯化亚砜(SOCl2)液体是一种重要的有机合成试剂,还用于农药、医药、燃料的生产等.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能发生丁达尔现象 | |
| B. | 胶体粒子能通过滤纸空隙 | |
| C. | 胶体在一定条件下能稳定存在 | |
| D. | 胶体分散质粒子直径在1nm~100nm之间 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 新制氯水呈淡黄绿色(HCl) | |
| B. | 新制氯水中滴加AgNO3溶液生成白色沉淀(Cl-) | |
| C. | 向NaHCO3溶液中加入新制氯水,有无色气泡(H+) | |
| D. | 将有色布条放入新制氯水中,有色布条褪色(HClO) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
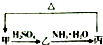 甲、乙、丙三种物质之间有如下转化关系(如图):
甲、乙、丙三种物质之间有如下转化关系(如图):查看答案和解析>>
科目:高中化学 来源: 题型:解答题
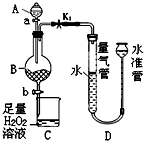 工业生产中会产生大量的废铁屑,可将其“变废为宝”制成化工原料氯化铁.实验室中利用如图所示装置探究由废铁屑制备FeCl3•6H2O晶体的原理并测定铁屑中铁单质的质量分数(杂质不溶于水且不与酸反应).
工业生产中会产生大量的废铁屑,可将其“变废为宝”制成化工原料氯化铁.实验室中利用如图所示装置探究由废铁屑制备FeCl3•6H2O晶体的原理并测定铁屑中铁单质的质量分数(杂质不溶于水且不与酸反应).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①、②、③、④均只有两种结构 | |
| B. | ①的同分异构体数目与④的相同 | |
| C. | ③一定是丙醛 | |
| D. | 若②与④能发生酯化反应,则生成的酯最多有2种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com