
����Ŀ�����ܱ���Ϊ21������߷�չDZ���������Դ��������Ч����������������õ���Ҫ�о�����
(1)![]() ��һ��DZ�ڵĴ�����ϣ�����Nԭ�ӵļ۵����Ų�ʽΪ________________��
��һ��DZ�ڵĴ�����ϣ�����Nԭ�ӵļ۵����Ų�ʽΪ________________��
(2)![]() �ļ����ɴ�С��˳��Ϊ________________________��
�ļ����ɴ�С��˳��Ϊ________________________��![]() �ĵ�һ�������ɴ�С��˳��Ϊ_______________________________��
�ĵ�һ�������ɴ�С��˳��Ϊ_______________________________��
(3)![]() �����ͻ�ϩ�ഢ����ϣ��о�֤������ӳ�ƽ��ṹ����ͼ��ʾ����
�����ͻ�ϩ�ഢ����ϣ��о�֤������ӳ�ƽ��ṹ����ͼ��ʾ����
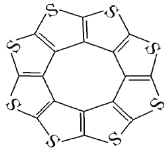
��![]() ������
������![]() ԭ�Ӻ�
ԭ�Ӻ�![]() ԭ�ӵ��ӻ�������ͷֱ�Ϊ_________________________��
ԭ�ӵ��ӻ�������ͷֱ�Ϊ_________________________��
�ڲ��![]() ��̼����ļ�������C-S����C=S��֮�䣬��ԭ�������________________________________________________��
��̼����ļ�������C-S����C=S��֮�䣬��ԭ�������________________________________________________��
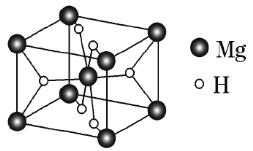
(4)ij��ͭ���Ͻ�����д���ܣ����������������ܶѻ��ṹ��![]() ԭ��λ�����ģ�Agԭ��λ�ڶ��㣬Hԭ�ӿɽ�����Cuԭ�Ӻ�Agԭ�ӹ��ɵ��������϶�С�����
ԭ��λ�����ģ�Agԭ��λ�ڶ��㣬Hԭ�ӿɽ�����Cuԭ�Ӻ�Agԭ�ӹ��ɵ��������϶�С�����![]() ԭ�ӵ�ͬ�������þ��崢���ľ����ṹ��
ԭ�ӵ�ͬ�������þ��崢���ľ����ṹ��![]() ����ͼ�����ƣ��þ��崢���Ļ�ѧʽΪ_________________________��
����ͼ�����ƣ��þ��崢���Ļ�ѧʽΪ_________________________��
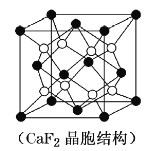
(5)![]() �ǽ����⻯�ﴢ����ϣ��侧����ͼ��ʾ���þ�����ܶ�Ϊ
�ǽ����⻯�ﴢ����ϣ��侧����ͼ��ʾ���þ�����ܶ�Ϊ![]() ����þ��������Ϊ___________
����þ��������Ϊ___________![]() ���ú�
���ú�![]() �Ĵ���ʽ��ʾ����
�Ĵ���ʽ��ʾ����
���𰸡�![]()
![]()
![]() ̼ԭ��Ϊ
̼ԭ��Ϊ![]() �ӻ�����ԭ��Ϊ
�ӻ�����ԭ��Ϊ![]() �ӻ�
�ӻ� ![]() ��̼�������һ���̶ȵ�˫������
��̼�������һ���̶ȵ�˫������ ![]()
![]()
��������
��1����̬��ԭ�ӵĵ����Ų�ʽΪ![]() ���۵����Ų�ʽΪ
���۵����Ų�ʽΪ![]() ��
��
��2����������м���Ϊ109��28�䣬ˮ��������¶Ե��Ӷ�![]() ���ļ�ѹ�����¼���С��109��28�䣬��������̼�еļ���Ϊ180�㣬��˼����ɴ�С��˳��Ϊ
���ļ�ѹ�����¼���С��109��28�䣬��������̼�еļ���Ϊ180�㣬��˼����ɴ�С��˳��Ϊ![]() ��ͬ����Ԫ������ԭ�����������ӣ���һ������Խ��Խ���ǿ��ǵ���ԭ��
��ͬ����Ԫ������ԭ�����������ӣ���һ������Խ��Խ���ǿ��ǵ���ԭ��![]() Ϊ�������ȶ��ṹ����˵�������ʵ����ܴ�С����Ϊ
Ϊ�������ȶ��ṹ����˵�������ʵ����ܴ�С����Ϊ![]() ��
��
��3����ÿ��̼ԭ����Χ��3��̼ԭ�ӣ���3��![]() ����1��
����1��![]() �������
�������![]() �ӻ�����ÿ����ԭ����Χ��2��ԭ�ӣ�����2�Թ¶Ե��ӣ����Ϊ
�ӻ�����ÿ����ԭ����Χ��2��ԭ�ӣ�����2�Թ¶Ե��ӣ����Ϊ![]() �ӻ���
�ӻ���
������![]() ��̼�������һ���̶ȵ�˫�����ʣ�˫���ij��ȱȵ����̣����̼����ij��Ƚ���
��̼�������һ���̶ȵ�˫�����ʣ�˫���ij��ȱȵ����̣����̼����ij��Ƚ���![]() ��
��![]() ֮�䣻
֮�䣻
��4�����ڶ����ԭ�Ӱ�![]() ���㣬�������ĵ�ԭ�Ӱ�
���㣬�������ĵ�ԭ�Ӱ�![]() ���㣬�����ھ����ڲ���ԭ�Ӱ��������㣬ͭԭ��λ�����ģ����һ����
���㣬�����ھ����ڲ���ԭ�Ӱ��������㣬ͭԭ��λ�����ģ����һ����![]() ��ͭԭ�ӣ���ԭ��λ�ڶ��㣬���һ����
��ͭԭ�ӣ���ԭ��λ�ڶ��㣬���һ����![]() ����ԭ�ӣ�����ԭ��ȫ��Ƕ�ھ����ڣ�һ����8����ԭ�ӣ��ʴ����Ļ�ѧʽΪ
����ԭ�ӣ�����ԭ��ȫ��Ƕ�ھ����ڣ�һ����8����ԭ�ӣ��ʴ����Ļ�ѧʽΪ![]() ��
��
��5�������к���2��Mg��4��H��ֱ�Ӵ�����ߵ�ԭ���������������������Ϊ![]() g������
g������![]() ��ó�
��ó�![]() ��
��


 ����������������ϵ�д�
����������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���о�����β���IJ�����ת���Ի�����������Ҫ���塣����β�����е���Ԫ������ͬʱʵ��CO��CxHy��NOn���ֳɷֵľ�����
(1)��֪�Ȼ�ѧ����ʽ��
CH4(g)��2O2(g)��CO2(g)��2H2O(l) ��H����890.3 kJ��mol��1
N2(g)��O2(g)![]() 2NO(g) ��H����180 kJ��mol��1
2NO(g) ��H����180 kJ��mol��1
��ӦCH4(g)��4NO(g)��CO2(g)��2N2(g)��2H2O(l) ��H��____kJ��mol��1��
(2)�о��������¶ȶ�CO��CxHy��NOn�IJ������ŷ��нϴ�Ӱ�졣
�������������ڵ��¶�Խ�ߣ����ɵ�NOԽ�࣬ԭ����____��
����������������ʱ������β�����ŷŵ�CO��CxHy��NOnŨ�Ƚϸߣ�һ��ʱ���Ũ�����͡�������������ʱ�ŷ�CO��CxHy��NOnŨ�Ƚϸߵ�ԭ����____��
(3)��������CO��CxHy��NOn��ת����ͼ1��ʾ��������W�ɽ���ͼ2 (����Ҷ�������ͼ)ȷ����
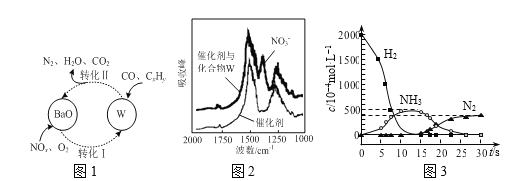
����ͼ1��ʾת���У�W�Ļ�ѧʽΪ____����ת����������CO�����ʵ���Ϊ1mol������N2�����ʵ���Ϊ1mol����CxHy��ԭ��W�����ʵ���Ϊ____��
����H2����CO��CxHy��W��Ӧ���ù����������Ũ����ʱ��ı仯��ϵ��ͼ3��ʾ���ù��̷�Ϊ��������һ����Ӧ���ĵ�H2��W�����ʵ���֮����____��
(4)β�����������У���ʱ�����N2O����ͬλ��ʾ�ٷ��о�����N2O�IJ�����NO�йء�������������15NO��NH3��һ��������Ӧʱ���õ���N2O��������15NNO��д���÷�Ӧ�Ļ�ѧ����ʽ��____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ��ȤС�����I2-CCl4����ȡ�Ⲣ����CCl4���������ϵõ�������Ϣ��
I2 | �Ϻ�ɫ���壬�е�184.3��C��������������������������ˮ�е��ܽ�Ⱥ�С�������������л��ܼ��� |
CCl4 | ��ɫ�ж�Һ�壬�е�76.8�棬�ӷ�����ˮ�������ܣ������Ҵ������ѡ��ȷ¼�ʯ���ѵȻ��ܣ�����ȼ�գ������л��ܼ��� |
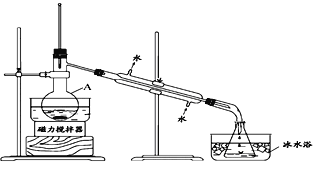
I����ȤС����ݱ�����Ϣ�������ѧ֪ʶ������ͼ��װ��������ʵ�飺
��1����װ��������A��������____________��
��2����ƿ���ڱ�ˮ�е�Ŀ����_____________��
��3��ʵ�������ֵõ���CCl4��dz�Ϻ�ɫ��Ϊ��һ���ᴿCCl4������ó��ӷ�Һ�ķ��������ᴿ�������в���������ȷ���ǣ�_______________________________��
�پ��ã���Һ��ֲ��Һ �ڼ����Թ�����Na2SO3��Һ �۳�������� �ܽ���������Һת�Ƶ���Һ©���� �ݶԷ�Һ©�����м�©
II�����ڷ���Iû�дﵽԤ��Ŀ�꣬��ȤС�����趨���·�������ʵ�飺
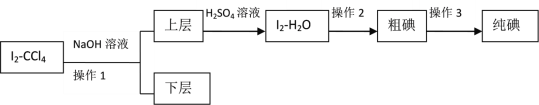
��֪��3I2��6NaOH��5NaI��NaIO3��3H2O
��4������2��������____________��
��5���μ���������ʱ����Һ��ɫ��ƣ���д����Ӧ�����ӷ���ʽ��________________��
��6����ʵ���б���Ҫ����NaOH��Һ��Ũ�Ƚ�_______���������������������������_______��������������С�����������ǣ�__________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��![]() Ϊԭ������������������ֶ�����Ԫ�أ�A�����ڱ�ԭ�Ӱ뾶��С��Ԫ�أ�
Ϊԭ������������������ֶ�����Ԫ�أ�A�����ڱ�ԭ�Ӱ뾶��С��Ԫ�أ�![]() ͬ���������ڣ�C��L���������K���3����Eԭ�ӵĺ����������Bԭ����������2��������˵������ȷ���ǣ� ��
ͬ���������ڣ�C��L���������K���3����Eԭ�ӵĺ����������Bԭ����������2��������˵������ȷ���ǣ� ��
A.������EԪ�ص���������������������ά
B.![]() ����Ԫ���γɵĻ�������һ��ֻ�����ۼ�
����Ԫ���γɵĻ�������һ��ֻ�����ۼ�
C.��Ԫ��![]() ��ɵ�ij�ֻ��������
��ɵ�ij�ֻ��������![]() ��Ӧ����
��Ӧ����![]()
D.Ԫ��A��![]() �γɵij����������У����ȶ�����õ���AD
�γɵij����������У����ȶ�����õ���AD
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���о��绯ѧԭ����Ӧ���зdz���Ҫ�����塣
��1��п�̵�أ��׳Ƹɵ�أ� ��һ��һ�ε�أ�������Ӧ�ù㷺��
��п�̵�ظ����ϵĵ缫��ӦʽΪ��______________________________��
������ͨ�����ԣ�п�̵����Ƚϣ�����п�̵�ص��ŵ���____________________���ش�һ�����ɣ���
��2��Ǧ����������Ķ��ε�أ�Pb��PbO2��2H2SO4 ![]() 2PbSO4��2H2O��
2PbSO4��2H2O��
�ٳ��ʱ������ӦΪ��________________________________________��
����Ǧ����Ϊ��Դ���е�ⱥ��ʳ��ˮʵ�飨ʯī��Ϊ��������Ϊ������ʳ��ˮ500mL���¶�Ϊ���£�������·����0.05mol����ת��ʱ��ʳ��ˮ��pHΪ______��������Һ������䣬��������ģ���
��3��ͼ1�ǽ�����M����������صĹ���ԭ�����ҹ��״��ĺ�����������Ϊ����������Ϊ��������ˮΪ�������Һ����ط�ӦΪ��___________________________ ��

�������������ӽ���Ĥȼ�ϵ��ʵ���������ᡢ���硢������λһ��Ľ�ϣ�ԭ����ͼ2��ʾ��Pt2�ϵĵ缫��ӦʽΪ��_______________________________________ ��
��4���������ƣ�Na2FeO4��������ˮ����һ�����Ͷ��ˮ�������������õ�ⷨ��ȡ��Fe��2H2O��2OH![]() FeO42��3H2��������ԭ����ͼ��ʾ��
FeO42��3H2��������ԭ����ͼ��ʾ��

װ��ͨ������缫���������Ϻ�ɫ��FeO42�����缫�����ݲ��������һ��ʱ���c��OH�����͵�������_____________��������ҡ��������ҡ�����������ӦΪ��___________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ҹ�ij�����Ŷ������һ�����������洢��ת��װ�ã�����ͼ��ʾ�����պ�K2���Ͽ�K1ʱ�����Ⲣ���ܣ��Ͽ�K2���պ�K1ʱ�����硣����˵���������
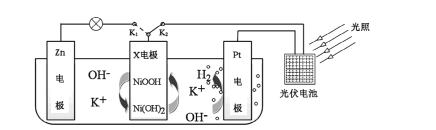
A.����ʱ����Һ��K+��Pt�缫�ƶ�
B.����ʱ��X�缫��ӦʽΪ![]()
C.����ʱ��Zn�缫������Һ��pH����
D.����ʱ��װ���е��ܷ�ӦΪ![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����仯��������������������������Ҫ�����ã�
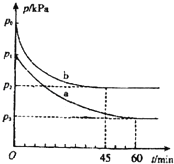
2SO2��g��+O2��g��2SO3��g����H=��198kJmol��1���Ʊ��������Ҫ��Ӧ��
��1�����ݻ�ΪV L���ܱ���������ʼ����2mol SO2��1mol O2����Ӧ�ڲ�ͬ�����½��У���Ӧ��ϵ��ѹǿ��ʱ��ı仯��ͼ��ʾ����ʵ��a��ȣ�ʵ��b�ı�������� ���жϵ����� ��
��2������������һ�������»����Է������·�Ӧ��
SO2��g��+NO2��g��SO3��g��+NO��g����H=��42kJmol��1��
��1L�����ܱ������г���SO2��g����NO2��g��������ʵ���������£�
ʵ���� | �¶� | ��ʼʱ���ʵ���/mol | ƽ��ʱ���ʵ���/mol | |
N��SO2�� | N��NO2�� | N��NO�� | ||
�� | T1 | 0.80 | 0.20 | 0.18 |
�� | T2 | 0.20 | 0.80 | 0.16 |
�� | T3 | 0.20 | 0.30 | a |
��ʵ����У���2minʱ��÷ų���������4.2kJ����0��2minʱ���ڣ���SO2��g����ʾ��ƽ����Ӧ����v��SO2��= �����¶��µ�ƽ�ⳣ�� ��
��ʵ����У��ﵽƽ��ʱ��NO2��ת����Ϊ ��
���ɱ������ݿ���֪��Tl T2�����������������=�������жϵ������� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ڱ���������ȷ���ǣ� ��
A.���ķ���ʽΪC6H6��������ʹ����KMnO4��Һ��ɫ�����ڱ�����
B.�ӱ��Ŀ�����ʽ(![]() )�����������к���̼̼˫����Ӧ����ϩ��
)�����������к���̼̼˫����Ӧ����ϩ��
C.�ڴ��������£�����Һ�巴Ӧ�����屽�������˼ӳɷ�Ӧ
D.������Ϊƽ���������νṹ��6��̼ԭ��֮��ļۼ���ȫ��ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��A��g����2B��s��![]() 3C ��g�� ��H����a kJ��mol��1 ��a��0��������˵����ȷ����
3C ��g�� ��H����a kJ��mol��1 ��a��0��������˵����ȷ����
A.����ϵ�� 3v ��A��=v ��C��ʱ����Ӧ�ﵽ��ѧƽ��
B.�ﵽ��ѧƽ������� 1mol A ��ͬʱ���� 2mol B
C.�ﵽ��ѧƽ���Ӧ�ų�������һ��С�� a kJ
D.�ﵽ��ѧƽ������ݻ����䲢ͨ��������壬ƽ�������ƶ�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com