
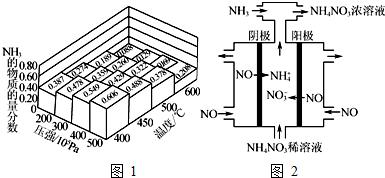
���� ��1������߰������ʣ���������ʡ�ƽ���ƶ��ĽǶȷ����Ϳɣ�
�ڻ�ѧƽ�ⳣ��ֻ���¶ȵ�Ӱ�죻
��2���������Ȼ�ѧ����ʽ��˹���ɼ���õ������Ȼ�ѧ����ʽ���Ӷ��õ���Ӧ�ȣ�
�ڰ��������������Һ��Ӧ�����¡��Ȼ��ơ�ˮ��д����ѧ����ʽ����дΪ���ӷ���ʽ��
��3���ٹ�ҵ�ϵ��NO�Ʊ� NH4NO3����װ��ͼ��֪��������������Ӧ��NO����������NO3-������������ԭ��Ӧ��NO����ԭ����NH4+��
���ܷ�Ӧ����ʽΪ��8NO+7H2O$\frac{\underline{\;���\;}}{\;}$3NH4NO3+2HNO3��ͨ���NH3�����ʵ�������Ӧ�����ɵ���������ʵ�����ȣ�
��4���Ȱ���ˮ��Ӧ����ƽ�⣺NH2Cl+H2O?NH3+HClO����ƽ���ƶ��ĽǶȷ�����
��� �⣺��1����a�����ó�����������ѧ��Ӧ����������a����
b�������ʵ��Ĵ������ӿ�ϳɰ������ʣ���b��ȷ��
c����ԭ������ѹ���ӿ��˺ϳɰ������ʣ�ƽ�������ƶ�����c��ȷ��
d������Һ����������ȥҺ����ƽ�������ƶ�����d��ȷ��
�ʴ�Ϊ��bcd��
��ͼ1����ʾ��ƽ����ϵ��NH3�����ʵ�������Ϊ0.549��0.478ʱ���¶ȶ���400�棬�¶���ͬ����ѧƽ�ⳣ����ȣ��ʴ�Ϊ��=��
��2������֪a��N2��g��+2O2��g��=2NO2��g����H=+67.7kJ/mol��
b��N2H4��g��+O2��g��=N2��g��+2H2O��g����H=-534.0kJ/mol��
c��NO2��g���T$\frac{1}{2}$N2O4��g������H=-28.0kJ•mol-1��
�ɸ�˹����b��2-a-c��2�õ����Ȼ�ѧ����ʽ��2N2H4��g��+N2O4��g��=3N2��g��+4H2O��g����H=-1079.7 kJ/mol��
�ʴ�Ϊ��-1079.7��
�ڰ��������������Һ��Ӧ�����¡��Ȼ��ơ�ˮ����ѧ����ʽΪ2NH3+NaClO�TNaCl+N2H4+H2O�����ӷ���ʽΪ2NH3+ClO-�TCl-+N2H4+H2O��
�ʴ�Ϊ��2NH3+ClO-�TCl-+N2H4+H2O��
��3���ٹ�ҵ�ϵ��NO�Ʊ� NH4NO3����װ��ͼ��֪��������������Ӧ��NO����������NO3-������������ԭ��Ӧ��NO����ԭ����NH4+��������ӦΪNO-3e-+2H2O=NO3-+4H+��������ӦΪ��NO+5e-+6H+=NH4++H2O��
�ʴ�Ϊ��NO+5e-+6H+�TNH4++H2O��
���ܷ�Ӧ����ʽΪ��8NO+7H2O$\frac{\underline{\;���\;}}{\;}$3NH4NO3+2HNO3�����ɵ�����ͷ�Ӧ��NO�����ʵ���֮�ȵ���2��8=1��4��ͨ���NH3�����ʵ�������Ӧ�����ɵ���������ʵ�����ȣ����ͨ���NH3��ʵ�ʲμӷ�Ӧ��NO�����ʵ���֮������Ϊ1��4��
�ʴ�Ϊ��1��4��
��4���Ȱ���ˮ��Ӧ����ƽ�⣺NH2Cl+H2O?NH3+HClO�����������£���С��NH3��Ũ�ȣ�ƽ������ʹ������Ũ�ȱ��
�ʴ�Ϊ���Ȱ���ˮ��Ӧ����ƽ�⣺NH2Cl+H2O?NH3+HClO������������ƽ������ʹ������Ũ�ȱ��
���� ���⿼��ϳɰ�������ѡ��Ӧ�ȵļ��㡢���ԭ������ѧƽ���Ӧ�ã��ۺ���ǿ����Ŀ�Ѷ��еȣ�������߰������ʣ���������ʡ�ƽ���ƶ��ĽǶȷ�����Ϊ������״��㣮


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ҵ�οɴ���ʳ��ʳ�� | B�� | �ӵ�ʳ�����ӵ��ǵ���� | ||
| C�� | ʳ���Ǻ����Ƽ����Ҫԭ��֮һ | D�� | ��ҵ�ϵ�ⱥ��ʳ��ˮ����ȡ�ռ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ϩ��HBr�����ӳɷ�Ӧ | B�� | ������������Ӧ | ||
| C�� | ��ϩ�ϳɾ���ϩ | D�� | �Ҵ�������������ȩ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��Ʒ����Һ�зֱ�ͨ��SO2��Cl2��Ʒ�����ɫ | |
| B�� | ���ѻ����ͺͱ���ϩ�зֱ������ˮ����ˮ����ɫ | |
| C�� | �ֱ����ʢ���Ȼ�狀͵��ʵ���Թܣ��ڱڻ�ܿھ��й������� | |
| D�� | �ֱ�������Һ�м��뱥���������Һ�ͼ�ȩ��Һ�����й������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
 ����Ƥा��п�������Ч����Ƥ�ؾ��п������˾���Ч��������һ�������¿ɷ�����ͼ��ʾ��ת��������˵����ȷ���ǣ�������
����Ƥा��п�������Ч����Ƥ�ؾ��п������˾���Ч��������һ�������¿ɷ�����ͼ��ʾ��ת��������˵����ȷ���ǣ�������| A�� | ����Ƥ�����Ƥ�ػ�Ϊͬϵ�� | |
| B�� | ��������Ƥ�����Ƥ�ؿ�����ˮ | |
| C�� | 1 mol��Ƥ��������3 mol NaOH��Ӧ | |
| D�� | ÿ������Ƥष�����������ȫ�ӳɺ�IJ����к���5������̼ԭ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
 ��һ�������£����ֺ���ͬ�ֽ���Ԫ�صĵ��ʻ��仯����ܰ���ͼ��ͷ����ʵ��һ��ת����������⣩���ý���Ԫ�ؿ����� ��������
��һ�������£����ֺ���ͬ�ֽ���Ԫ�صĵ��ʻ��仯����ܰ���ͼ��ͷ����ʵ��һ��ת����������⣩���ý���Ԫ�ؿ����� ��������| A�� | �٢� | B�� | �ڢ� | C�� | �٢� | D�� | �ۢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ��� | KMnO4��Һ /ml | H2C2O4��Һ /ml | 10%�������/mL | �¶�/�� | �������� |
| �� | 8.00 | 5.00 | 3.00 | 20 | |
| �� | 8.00 | 5.00 | 3.00 | 30 | |
| �� | 8.00 | 5.00 | 1.00 | 20 | 2.00 mL ����ˮ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | KCl | B�� | NaF | C�� | Na2O | D�� | NaCl |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com