
| A、明矾溶液中加入过量的氨水:Al3++4OH-═AlO2-+2H2O |
| B、漂白粉溶液中通入过量的二氧化碳:Ca2++2ClO-+CO2+H2O═CaCO3↓+2HClO+CO32- |
| C、FeBr2溶液中加入过量的氯水:2Br-+Cl2═Br2+2Cl- |
| D、澄清的石灰水中加入过量的NaHCO3溶液:Ca2++2OH-+2HCO3-═CaCO3↓+2H2O+CO32- |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、石油气、煤油和石蜡的主要成分都是碳氢化合物 |
| B、氯乙烷在NaOH水溶液中加热得到乙醇 |
C、由CH2=CH-COOCH3合成的聚合物为 |
| D、能与NaOH溶液反应且分子式为C2H4O2的有机物不一定是羧酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、容量瓶中原有少量的蒸馏水 |
| B、移液时,不慎将液体流到瓶外 |
| C、容量瓶盛过KOH溶液,使用前未洗涤 |
| D、定容时俯视刻度线 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1:1 | B、2:1 |
| C、3:1 | D、4:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、SiO2晶体中,1 mol硅原子与氧原子形成的共价键数是2NA |
| B、标准状况下,1 L己烷所含碳原子个数约为6NA/22.4 |
| C、3.2 g铜在硫蒸气中完全燃烧,转移的电子数为0.1NA |
| D、常温常压下,0.1 mol氖气含有的电子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
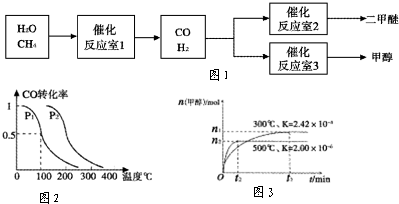
2- 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、由水电离产生的c(H+)=10-12mol/L的溶液中:K+、Na+、ClO-、I- | ||
B、c(H+)=
| ||
| C、常温下,c(H+)/c(OH-)=1×10-12的溶液:K+、AlO2-、CO32-、Na+ | ||
| D、pH=13的溶液中:AlO2-、Cl-、HCO3-、SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com