
| A、电极只能由两种不同的金属构成 |
| B、负极发生的电极反应是还原反应 |
| C、工作时其正极不断产生电子并经外电路流向负极 |
| D、能将化学能转变为电能 |


科目:高中化学 来源: 题型:
| A、高温下二氧化硅与碳酸钠反应放出二氧化碳,说明硅酸(H2SiO3)的酸性比碳酸强 |
| B、陶瓷、玻璃、水泥容器都能贮存氢氟酸 |
| C、石灰抹墙、水泥砌墙的硬化过程原理相同 |
| D、高纯度的硅广泛用于制作计算机芯片 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验事实 | 解释或结论 |
| A | 2N2O5(g)?4NO2(g)+O2(g)△H>0 在低温下不能自发进行 |
这是一个熵增的反应 |
| B | 压缩针筒内的NO2和N2O4混合气体, 颜色先变深后变浅 |
增大压强,平衡向生成N2O4的方向移动,新平衡比旧平衡压强小 |
| C | 锌与稀硫酸反应过程中,开始某段时间反应速率逐渐增大 | 该反应是放热反应 |
| D | 已建立平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动 | 反应物的浓度不一定降低 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、某醋酸溶液的pH=a,将此溶液稀释1倍后,溶液的pH=b,则a>b |
| B、pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的100倍 |
| C、1.0×10-3mol/L盐酸的Ph=3.0,1.0×10-8mol/L盐酸的pH=8.0 |
| D、相同温度下,1 mol?L-1氨水溶液与0.5 mol?L-1氨水溶液中,c(OH-)之比是2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
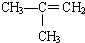 ⑥CaCO3 ⑦
⑥CaCO3 ⑦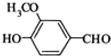 ⑧CH3CH2Br.
⑧CH3CH2Br.| A、①③④⑤ | B、⑥⑦⑧ |
| C、②⑦⑧ | D、②⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 待测物质 | 实验操作与现象 |
| A. NH3 | 用玻璃棒蘸浓硫酸靠近,产生白烟,证明有氨气 |
| B. Fe2+ | 取少量待测液,先滴加KSCN(硫氰化钾)溶液,无明显现象,再通入氯气,有红色沉淀产生,则有Fe2+ |
| C. Cl2 | 用湿润的淀粉碘化钾试纸若试纸变蓝,则是氯气 |
| D. Cl- | 取待测液,加稀硝酸酸化,再滴加AgNO3溶液,若出现白色沉淀,则被检验的溶液中含有Cl- |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碱金属元素与氧气反应均能形成过氧化物 |
| B、碱金属的密度随着原子序数的递增逐渐减小 |
| C、碱金属元素的最高价氧化物对应的水化物的碱性随着原子序数的递增依次增强 |
| D、碱金属元素的阳离子的氧化性随着原子序数的递增依次增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、两种气体都被吸收,并有BaSO4沉淀生成 |
| B、只有BaSO4沉淀,SO2通入溶液中无沉淀生成 |
| C、生成BaSO3和BaSO4两种沉淀 |
| D、只生成BaSO3沉淀,SO3从溶液中逸出 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com