
分析 (1)在水溶液中或熔融状态下能导电的化合物为电解质;在水溶液中和熔融状态下均不能导电的化合物为非电解质;
(2)按照不同的分类标准进行分类的方法为交叉分类法;
(3)实验室制备氢氧化铁胶体是将氯化铁溶液逐滴滴入沸水中;胶体的特性是丁达尔效应;氯化钠晶体在乙醇溶液中也会形成胶体.
解答 解:(1)在水溶液中或熔融状态下能导电的化合物为电解质,故②⑥是电解质;在水溶液中和熔融状态下均不能导电的化合物为非电解质,故①③是非电解质,故答案为:②⑥;①③;
(2)按照不同的分类标准进行分类的方法为交叉分类法,故碳酸钠根据阳离子是钠离子、阴离子是碳酸根,故分别属于钠盐和碳酸盐的分类方法为交叉分类法,故答案为:交叉分类法;
(3)实验室制备氢氧化铁胶体是将氯化铁溶液逐滴滴入沸水中,化学方程式为FeCl3+3H2O$\frac{\underline{\;\;△\;\;}}{\;}$ Fe(OH)3(胶体)+3HCl;胶体的特性是丁达尔效应,故可以用激光笔照射,有一条明亮的光路,则证明有胶体生成;氯化钠晶体在乙醇溶液中也会形成胶体,故可以有丁达尔效应,故答案为:FeCl3+3H2O$\frac{\underline{\;\;△\;\;}}{\;}$ Fe(OH)3(胶体)+3HCl;用激光笔照射,有一条明亮的光路,则有胶体生成;③.
点评 本题考查了电解质和非电解质的判断和胶体的制备以及性质,难度不大,应注意的是电解质和非电解质均为化合物,单质和混合物既不是电解质也不是非电解质.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 加入过量的KI溶液充分反应后,Kw(AgCl)减小 | |
| B. | 加入过量的KI溶液充分反应后,溶液中Ag+和I-的浓度之积等于Ksp(AgI) | |
| C. | 加入过量的KI溶液充分反应后,溶液中Ag+和Cl-的浓度之积等于Ksp(AgCl) | |
| D. | Ksp(AgI)<Ksp(AgCl) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 加入过量Na2CO3溶液:Na+、Ca2+、NH4+、NO3-、H+ | |
| B. | 加入适量NaHCO3溶液:Na+、Ca2+、NH4+、NO3-、HCO3- | |
| C. | 加入适量NaOH溶液:Na+、Ca2+、NH4+、NO3-、OH- | |
| D. | 加入过量FeSO4和稀硫酸:Fe2+、Fe3+、NH4+、Ca2+、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,5.6L CCl4含有的分子数为0.25NA | |
| B. | 标准状况下,14 g氮气含有的核外电子数为5NA | |
| C. | 标准状况下,22.4 L任意比的氢气和氯气的混气中含有分子总数均为NA | |
| D. | 在标准状况下,18gH2O所含有的电子数不是10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
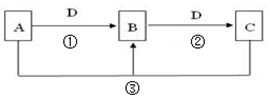 常见无机物A、B、C、D存在如图转化关系:
常见无机物A、B、C、D存在如图转化关系:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 阴极发生氧化反应,其电极反应式:Ni2++2e-═Ni | |
| B. | 电解后,溶液中存在的金属阳离子只有Ni2+和Zn2+ | |
| C. | 电解后溶液中Ni2+数目减少 | |
| D. | 电解后,电解槽底部的阳极泥中有Pt和Fe |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com