
【题目】中国的锰矿石和锌矿石产地在云南、广东、青海等。软锰矿是一种常见的锰矿石,其主要成分是MnO2,含少量Al2O3和SiO2。闪锌矿主要成分是ZnS,含少量FeS、CuS、CdS等杂质,晶体属于六方晶系。现以软锰矿和闪锌矿为原料制备MnO2和Zn,其简化流程如下。

已知:Ⅰ.矿石中所有金属元素在滤液A中均以离子形式存在。
Ⅱ.各种金属离子完全沉淀的pH如下表:
Zn2+ | Mn2+ | Fe2+ | Fe3+ | Al3+ | |
pH | 8.0 | 10.1 | 9.0 | 3.2 | 4.7 |
回答下列问题:
(1)步骤①中MnO2、CuS与硫酸共热时有淡黄色物质析出,请写出该反应的化学方程
式___________________。
(2)步骤②加入适量金属锌是为了回收金属,回收金属的主要成分是_________________。
(3)步骤③中MnO2的作用是________________,另外一种物质X可以是__________。
A.ZnO B.MgO C.Cu2(OH)2CO3 D.MnCO3
(4)锂离子电池的正极材料有多种,其中MnO2与Li构成LiMnO2是一种常见的正极材料。电池反应方程式为:Li1-xMnO2+LixC6=LiMnO2+6C,写出该锂离子电池的正极电极反应式_____________________。
已知:HCN的电离常数K=4.9×10-10,H2S的电离常数K1=1.3×10-7,K2=7.0×10-15,
向NaCN溶液中通入少量的H2S气体,反应的离子方程式为_______________________。
在废水处理领域中常用H2S将Mn2+转化为MnS除去,向含有0.020 mol·L-1 Mn2+废水
中通入一定量的H2S气体,调节溶液的pH=a,当HS-浓度为1.0×10―4 mol·L-1时,Mn2+开始沉淀,则a=________。[已知:Ksp(MnS)=1.4×10-15]
【答案】 CuS+MnO2+2H2SO4![]() CuSO4+MnSO4+ S+2H2O Cu、Cd 将Fe2+氧化为Fe3+ AD Li1-xMnO2+xLi++xe-=LiMnO2 CN-+H2S=HCN+HS- 5
CuSO4+MnSO4+ S+2H2O Cu、Cd 将Fe2+氧化为Fe3+ AD Li1-xMnO2+xLi++xe-=LiMnO2 CN-+H2S=HCN+HS- 5
【解析】矿石用硫酸酸浸时只有二氧化硅不溶,过滤后得到滤渣。滤液A中加入适量锌,将溶液中的Cu2+、Cd2+还原为Cu、Cd。然后加入二氧化锰氧化亚铁离子转化为铁离子,通过X调节溶液pH沉淀铁离子和铝离子,电解硫酸锰、硫酸锌得到二氧化锰、锌和硫酸。
(1)步骤①中MnO2、CuS与硫酸共热时有淡黄色物质析出,该物质是S,这说明二氧化锰是氧化剂,因此该反应的化学方程式为 CuS+MnO2+2H2SO4![]() CuSO4+MnSO4+S+2H2O;(2)步骤②加入适量金属锌是为了回收金属,滤液中Cu2+、Cd2+还原为Cu、Cd,所以回收金属的主要成分是Cu、Cd。(3)由于亚铁离子的沉淀pH解答,需要转化为铁离子,则步骤③中MnO2的作用是将Fe2+氧化为Fe3+。X是为了调节pH,由于不能引入杂质,则另外一种物质X可以是ZnO或MnCO3,答案选AD;(4)根据总反应式Li1-xMnO2+LixC6=LiMnO2+6C可判断该锂离子电池的正极是Li1-xMnO2发生得到电子的还原反应,电极反应
CuSO4+MnSO4+S+2H2O;(2)步骤②加入适量金属锌是为了回收金属,滤液中Cu2+、Cd2+还原为Cu、Cd,所以回收金属的主要成分是Cu、Cd。(3)由于亚铁离子的沉淀pH解答,需要转化为铁离子,则步骤③中MnO2的作用是将Fe2+氧化为Fe3+。X是为了调节pH,由于不能引入杂质,则另外一种物质X可以是ZnO或MnCO3,答案选AD;(4)根据总反应式Li1-xMnO2+LixC6=LiMnO2+6C可判断该锂离子电池的正极是Li1-xMnO2发生得到电子的还原反应,电极反应
式为Li1-xMnO2+xLi++xe-=LiMnO2。根据电离常数可知酸性:H2S>HCN>HS-,所以向NaCN溶液中通入少量的H2S气体,反应的离子方程式为CN-+H2S=HCN+HS-。Mn2+开始沉淀时溶液中S2-浓度是1.4×10-15/0.020=7.0×10-14mol/L。根据H2S的第二步电离平衡常数可知溶液中氢离子浓度是![]() ,则a=5。
,则a=5。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】某氧化还原反应中有反应物和生成物共六种:NO、FeSO4、Fe(NO3)3、H2O、HNO3和Fe2(SO4)3,其中FeSO4为反应物.则该反应中的还原产物为
A.Fe(NO3)3 B. HNO3 C. Fe2(SO4)3 D.NO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向氢氧化铁溶胶中逐滴加入一种液体,首先使溶胶发生凝聚而沉淀,继续加入使沉淀消失,这种液体是( )
A. 0.5mol/L氢氧化钠溶液 B. 0.5mol/L盐酸
C. 0.5mol/L氯化钾溶液 D. 蒸馏水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知卤代烃可以和钠发生反应,例如溴乙烷与钠发生反应为:2CH3CH2Br + 2Na![]() CH3CH2CH2CH3 + 2NaBr,应用这一反应,下列所给化合物中可以与钠合成环丁烷的是( )
CH3CH2CH2CH3 + 2NaBr,应用这一反应,下列所给化合物中可以与钠合成环丁烷的是( )
A. CH2BrCH2CH2CH2Br B. CH3CH2CH2CH2Br
C. CH3CHBrCHBrCH3 D. CH3Br
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃煤技术的改进,有助于合理控制温室效应、环境污染,并能进行资源化利用,还可重新获得燃料或重要工业产品。工业上以煤和水为原料通过一系列转化变为清洁能源氢气和工业原料甲醇。
(1)若碳的燃烧热为393.5kJ·mol-1,氢气的燃烧热为285.8kJ·mol-1。已知反应
C(s)+2H2O(g) ![]() CO2(g)+2H2(g) △H>0,能否求出该反应的△H_______(填“能”或“不能”)。若能则求出其△H(若不能请说明理由):_____________________。
CO2(g)+2H2(g) △H>0,能否求出该反应的△H_______(填“能”或“不能”)。若能则求出其△H(若不能请说明理由):_____________________。
(2)工业上也可以仅利用上述反应得到的CO2和H2进一步合成甲醇,反应方程式为:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H<0
CH3OH(g)+H2O(g) △H<0
①工业生产过程中CO2和H2的转化率________(填“前者大”、“后者大”、“一样大”或“无法判断”),为了提高甲醇的产率可以采取的措施是____________、____________(填两点)。
②在一恒温恒容密闭容器中充入1 mol CO2和3 mol H2进行上述反应。测得CO2和CH3OH(g)浓度随时间变化如图所示。
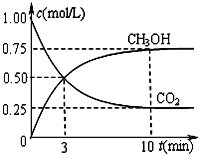
i.用H2表示0-3min内该反应的平均反应速率______________。
ii.该温度下的平衡常数为__________________。10 min后,保持温度不变,向该密闭容器中再充入1 mol CO2(g)和1 mol H2O(g),此时V正 _________V逆(填“>”、“<”或“=”)。
iii.对于基元反应aA+bB![]() cC+dD而言,其某一时刻的瞬时速率计算公式如下:正反应速率为V正=k正·c(A)a·c(B)b ;逆反应速率为V逆=k逆·c(C)c·c(D)d,其中k正、k逆为速率常数。若将上述反应视为基元反应则在上述条件下k逆∶k正=_________。反应进行到第3 min时V正 :V逆 =________。
cC+dD而言,其某一时刻的瞬时速率计算公式如下:正反应速率为V正=k正·c(A)a·c(B)b ;逆反应速率为V逆=k逆·c(C)c·c(D)d,其中k正、k逆为速率常数。若将上述反应视为基元反应则在上述条件下k逆∶k正=_________。反应进行到第3 min时V正 :V逆 =________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,错误的是( )
A. 苯与浓硝酸、浓硫酸共热并保持55-60℃反应生成硝基苯
B. 苯乙烯在合适条件下催化加氢可生成乙基环己烷
C. 乙烯与溴的四氯化碳溶液反应生成1,2-二溴乙烷
D. 甲苯与氯气在光照下反应主要生成2,4-二氯甲苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近《科学》杂志评出十大科技突破,其中“火星上‘找’到水的影子”排名笫一。下列关于水的说法中正确的是
A. 水的电离是放热的过程 B. 加入电解质一定会破坏水的电离平衡
C. 水的电离和电解都需要电 D. 水、乙酸和硫酸钡均属于电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】除去下列物质中的杂质(括号内是杂质)所用试剂不正确的是( )
A. NaHCO3溶液[Na2CO3]:用CO2气体 B. Mg粉[Al]:用NaOH溶液
C. CO2气体[H2O]:用碱石灰 D. HNO3溶液[HCl]:用AgNO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可用甲烷和氧气按9:1的体积比混合,在200℃和10MPa的条件下,通过铜制管道反应制得甲醇:2CH4+O2=2CH3COH。
(1)已知一定条件下,CH4和CH3COH燃烧的热化学方程式分别为:
CH4(g)+SO2(g)=CO2(g)+2H2(g) △H=-802kJ/lmol
CH3OH(g)+l.5O2(g)=CO2(g)+2H2O(g) △H=-677kJ/mol
则2CH4(g)+O2(g)=2CH3OH(g) △H=__________
(2)甲烷固体氧化物燃料电池属于第三代燃料电池,是一种在中高温下直接将储存在燃料和氧化剂中的化学能高效、环境友好地转化成电能的全固态化学发电装置。其工作原理如下图所示。a是电池的____极(填“正”或“负”) ,b极的电极反应式为__________。

(3)工业上合成甲醇的另一种方法为:
CO(g)+2H2(g) ![]() CH3OH(g) △H=-90kJ/mol
CH3OH(g) △H=-90kJ/mol
T℃时,将2mol CO 和4molH2充入1L 的密闭容器中,测得H2的物质的量随时间变化如下图实线所示。
① 能用于判断反应已达化学平衡状态的是____________。
A.气体的总压强不再改变
B. H2与CH3OH的体积比不再改变
C.气体的密度不再改变
D.单位时间内消耗1mol CO,同时生成1mol CH3OH
② 请计算出T℃ 时反应的平衡常数K=_________________。
③ 仅改变某一实验条件再进行两次实验测得H2的物质的量随时间变化如图中虚线所示。曲线Ⅰ对应的实验条件改变是:________;曲线Ⅱ对应的实验条件改变是_________0。

④ a、b、c三点逆反应速率由大到小排列的顺序是__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com