
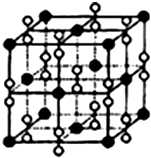
 氧元素与多种元素具有亲和力,所形成化合物的种类仅次于碳元素.
氧元素与多种元素具有亲和力,所形成化合物的种类仅次于碳元素.| m |
| V |
| 6-1×2 |
| 2 |
| 1 |
| 4 |
| 1 |
| 8 |
| 1 |
| 2 |
| 4×72 |
| NA |
| ||
| (540×10-10)3 |


科目:高中化学 来源: 题型:
| A、在1 L 0.2 mol?L-1的Na2CO3溶液中含有CO32-的数目为0.2NA |
| B、0.1 mol Na参加氧化还原反应,转移的电子数目一定是0.1 NA |
| C、电解精炼铜时,若阴极得到电子数为2NA个,则阳极质量减少64g |
| D、理论上氢氧燃料电池正极消耗11.2 L气体时,外线路通过电子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | X | Y | 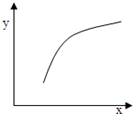 |
| A | 温度 | 容器内混合气体的密度 | |
| B | I2的物质的量 | H2的转化率 | |
| C | H2的浓度 | 平衡常数K | |
| D | 加入Ar的物质的量 | 逆反应速率 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH=1的溶液中:Fe2+、Cl-、Na+、NO3- |
| B、由水电离出的c(H+)=1×10-13mol/L的溶液中:Na+、CO32-、Cl-、K+ |
| C、pH≈7的溶液中:NH4+、HCO3-、Mg2+、SO42- |
| D、无色溶液中:Al3+、HCO3-、I-、Ca2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 物质结构[Cu(NH3)4]SO4?H2O是一种杀虫剂.
物质结构[Cu(NH3)4]SO4?H2O是一种杀虫剂.查看答案和解析>>
科目:高中化学 来源: 题型:

| 实验 序号 | 0 | 10 | 20 | 30 | 40 | 50 | |
| 1 | 800 | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 |
| 2 | 800 | 1.0 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 950 | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 和
和
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com