
| A. | H3O+和OH- | B. | CO和N2 | C. | HNO3和NO3- | D. | CH3+和NH4+ |
分析 根据粒子中质子数等于原子的质子数之和,中性微粒中质子数=电子数,阳离子的电子数=质子数-电荷数,阴离子的电子数=质子数+电荷数;
解答 解:A、H3O+的质子数为11,电子数为11-1=10,OH-的质子数为9,电子数为9+1=10,电子数相同,故A错误;
B、CO的质子数为14,电子数为14,N2的质子数为14,电子数为14,电子数相同,故B错误;
C、HNO3的质子数为1+7+8×3=32,电子数为32,NO3-的质子数为7+8×3=31,电子数为31+1=32,电子数相同,故C错误;
D、CH3+的质子数为6+1×3=9,电子数为9-1=8,NH4+的质子数为11,电子数为11-1=10,电子数不同,故D正确;
故选:D.
点评 本题主要考查微粒的质子数和电子数的关系,明确中性微粒、阳离子、阴离子的电子的数目计算是解答的关键,并注意中性微粒中质子数等于电子数.


 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | ②③ | B. | ②③④⑥ | C. | ②③③⑤ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溴乙烷与氢氧化钠溶液共煮后,加入硝酸银检验Br- | |
| B. | 用CuSO4溶液除去由电石和饱和食盐水反应生成的乙炔气体中的杂质 | |
| C. | 用苯、2mol/L的硝酸和3mol/L的硫酸制硝基苯 | |
| D. | 将溴乙烷与氢氧化钠的醇溶液共热后产生的气体通入酸性高锰酸钾溶液以检验乙烯的生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  验证酸性:H2CO3>H2SiO3 | B. | 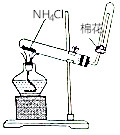 实验室制取氨气 | ||
| C. |  证明石蜡油分解生成的气体是乙烯 | D. | 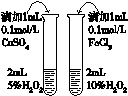 比较不同催化剂对反应速率的影响 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | H3PO3的结构为 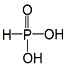 | |
| B. | H3AsO3的结构为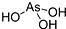 | |
| C. | H3AsO3与H3PO3一样,也为二元酸 | |
| D. | H3AsO3为三元酸,且价层电子对构型为正四面体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com