
(7分)
(1)在标准状况下,a.6.72 L CH4气体 b.3.01×1023个HCl气体分子 c.13.6g H2S气体 d.0.2mol NH3,下列对这四种气体的关系从大到小的排列是(用上述序号表示)。
①四种气体的物质的量___________________________________;
②标准状况下四种气体的密度_____________________________;
③四种气体的质量_______________________________________。
(2)阿伏加德罗曾做过这样一个实验:一抽空的密闭容器重Mg,在标准状况下,盛满以相同物质的量混合的NO和H2的混合气体后,称量为(M+Q)g。把混合气体排尽,再充满SO2气体,为使天平平衡,应在托盘天平的________边托盘上放置________g砝码。
(3)将10g复盐CuSO4·x(NH4)2SO4·yH2O加到过量的NaOH溶液中加热,生成的氨气用100 mL 0.5mol/L硫酸全部吸收,多余的硫酸用2mol/L NaOH溶液中和,用去NaOH溶液25 mL。已知复盐中SO的质量分数为48%,则x=________,y=________。
(1)①b>c>a>d ②b>c>d>a ③b>c>a>d
(2)右 M+4Q (3)1 6
解析试题分析:(1)在标准状况下a.6.72L CH4气体 b.3.01×1023个HCl气体分子 c.13.6g H2S气体 d.0.2molNH3,CH4气体的物质的量为0.3mol,HCl气体的物质的量为0.5mol,H2S气体的物质的量为0.4mol,NH3的物质的量为0.2mol,①四种气体的物质的量为b>c>a>d,故答案为:b>c>a>d;②各物质的摩尔质量分别为:CH4 为16g/mol,HCl为36.5g/mol ,H2S 为34g/mol,NH3为17g/mol,相同条件下,密度之比等于摩尔质量之比,所以密度b>c>d>a;③CH4气体的质量为0.3mol×16g/mol=4.8g,HCl的质量为0.5mol×36.5g/mol=18.25g,H2S的质量为13.6g,NH3的质量为0.2mol×17g/mol=3.4g,则四种气体的质量为b>c>a>d;(2)同一容器在同一条件下盛放不同的气体时,所含分子数必然相等,NO和H2按相同物质的量混合时,气体的平均相对分子质量为16,而SO2的相对分子质量为64,称量物品质量时,砝码应放在天平的右盘,设密闭容器内气体的物质的量为n,则盛满以相同物质的量混合的NO和H2的混合气体后,气体的质量为16n=Q,n=Q/16,当充满SO2气体时,气体的质量为:m=64n=4Q,容器的总质量为M+4Q,答案为:右; M+4Q; (3)已知复盐中SO42-的质量分数为48%,则硫酸根离子的物质的量为0.05mol;硫酸中氢离子的物质的量为:n(H+)=0.5mol?L-1×0.1L×2=0.1mol,氢氧化钠中和的硫酸中氢离子的物质的量为:2mol?L-1×0.025L=0.05mol,与NH3反应的H+的物质的量为:0.1mol-0.05mol=0.05mol,由于n(SO42-)=0.05mol,n(NH4+):n(SO42-)=0.05:0.05=1:1,即:2x:(x+1)=1:1,解得:x=1,复盐的化学式为CuSO4?(NH4)2SO4?yH2O,根据硫酸根离子的物质的量可知,10g该复盐的物质的量为:0.025mol,所以该复盐的摩尔质量为:M(复盐)=10g÷0.025mol=400g?mol-1,所以18y+64+96×2+18×2=400,解得:y=6,该复盐中x、y分别为1、6。
考点:考查以物质的量为中心的计算。


 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:单选题
设nA为阿伏加德罗常数的数值,下列说法正确的是( )
| A.常温常压下,1mol甲基所含的电子总数为10nA |
| B.14g乙烯和丙烯的混合气体中含有的碳原子数为nA |
| C.标准状况下,2.24 L苯中含有0.3 nA个碳碳双键 |
| D.常温常压下,1L 0.1mol·L-1 KMnO4与足量的FeSO4反应转移电子数为3nA |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
NA表示阿伏加德罗常数的值,下列说法正确的是
| A.常温下,在18g18O2中含有NA个氧原子 |
| B.标准状况下,17g NH3所含共价键数为NA个 |
| C.标准状况下,22.4L苯的分子数约为NA个 |
| D.1mol Na2O2中含有的阴离子数目为2NA个 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
标准状况下有①6.72L甲烷②3.01×1023个氯化氢分子③13.6gH2S气体④0.2mol氨
气。下列对这四种气体的关系从小到大顺序排列(用序号表示)
| A.体积______________________________ | B.密度__________________________ |
| C.质量______________________________ | D.氢原子数______________________ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(4分)将3.84 g Fe和Fe2O3的混合物溶于120 mL的盐酸,刚好完全反应,生成0.03 mol H2,若反应后的溶液中无Fe3+,且溶液体积不变,试求:
(1)原混合物中Fe2O3的质量为 ;
(2)原盐酸的物质的量浓度为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
临湘一中食堂以前烧煤,经过改造现在烧天然气,使校园环境有了很大的改善。天然气的主要成分是甲烷,若2克甲烷完全燃烧可放出QKJ的热量,请写出能表示甲烷燃烧热的热化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
元素A的单质能与H2化合生成HxA,在标准状况下8.5gHxA气体的体积是5.6L。含5.1g的HxA的溶液与200ml0.75mol/l的CuCl2溶液正好发生复分解反应,并生成黑色沉淀和一种强酸,则:
(1)A 元素的相对原子质量 ,若A 的质子数等于中子数,则A是 元素(填名称)。
(2)A的最高价氧化物是 (填化学式)。这一氧化物在室温下呈 态,将其熔化需要克服 。
(3)HxA与CuCl2溶液反应的离子方程式 。
(4)A的单质在常温下是固体,在常温常压下0.25mol该单质完全燃烧放出QkJ的热量。写出该反应的热化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
2014年全运会在辽宁举办,其开幕式就是一场焰火盛宴。
(1)焰火利用了部分金属元素特征的 反应,该反应属于 (填“物理”或“化学”)变化。
(2)如图所示的五元环代表A、B、C、D、E五种化合物,圆圈交叉部分指两种化合物含有一种相同元素,五种化合物由五种短周期元素组成,每种化合物仅含两种元素。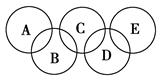
图中A是沼气的主要成分,B、E分子中所含电子数均为18,B不稳定,具有较强的氧化性,其稀溶液是医疗上广泛使用的消毒剂,E分子结构的球棍模型为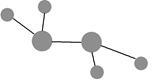 ,C与纯碱在高温下的反应是工业制玻璃的主要反应之一,D中所含两种元素的原子个数比为3∶4,电子总数之比为3∶2。根据以上信息回答下列问题:
,C与纯碱在高温下的反应是工业制玻璃的主要反应之一,D中所含两种元素的原子个数比为3∶4,电子总数之比为3∶2。根据以上信息回答下列问题:
①B的水溶液呈弱酸性,其主要的电离方程式可表示为 ,D的化学式是 。
②A、B、E中均含有的一种元素符号为 。
③C与纯碱反应的化学方程式为 。
④液态B与液态E反应可生成一种单质和一种常见液体,1 mol B参加反应放出热量Q kJ,其反应的热化学方程式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com