
【题目】为探讨浓度对化学平衡的影响,某同学对可逆反应 “2Fe3++2I-![]() 2Fe2++I2 △H<0”按下图所示步骤进行了一系列实验。
2Fe2++I2 △H<0”按下图所示步骤进行了一系列实验。

说明:0.005 mol·L-1的Fe2(SO4)3溶液颜色接近于无色。
(1)实验中要待实验Ⅰ溶液颜色不再改变时,才能进行实验Ⅱ,目的是 。
(2)实验Ⅱ中,ⅰ的现象是 ,该实验证明 。
(3)实验Ⅱ中,ⅲ的化学平衡向 移动(填“正反应方向”或“逆反应方向”);ⅲ的现象是溶液变浅,该现象 (填“能”或“不能”)说明化学平衡发生移动。如果前一空填“能”,则下一空不填;如果前一空填“不能”,则ⅲ的目的是 。
(4)实验Ⅱ中,ⅱ的现象是 ,即能证明增大生成物浓度化学平衡发生了逆向移动。
(5)除了上图中的方法外,若要使该可逆反应的化学平衡逆向移动,还可以采用的方法有 。
【答案】(1)反应达平衡状态
(2)生成黄色沉淀,溶液颜色变浅 反应物浓度减小,平衡向逆反应方向移动。
(3)逆反应方向 不能 为实验ⅱ做参照
(4)溶液颜色变得比ⅲ更浅
(5)加热(加入浓碘水)
【解析】
试题分析:本实验的目的是探讨可逆反应 2Fe3++2I-![]() 2Fe2++I2 △H<0中浓度对化学平衡的影响。
2Fe2++I2 △H<0中浓度对化学平衡的影响。
(1)实验中要待实验Ⅰ溶液颜色不再改变时,即反应达化学平衡状态时,才能进行实验Ⅱ。
(2)实验Ⅱ中,ⅰ中为Ag+与I-的反应,现象是生成黄色沉淀,溶液颜色变浅。证明反应物浓度减小,平衡向逆反应方向移动。
(3)实验Ⅱ中,ⅲ的化学平衡向逆反应方向移动;ⅲ的溶液变浅,并不能说明化学平衡发生移动,因为加水稀释,使溶液中各离子浓度降低;ⅲ的目的是为实验ⅱ做参照。
(4)实验Ⅱ中,ⅱ的溶液颜色变得比ⅲ更浅,即能证明增大生成物浓度化学平衡发生了逆向移动。
(5)若要使该可逆反应的化学平衡逆向移动,还可以采用的方法有加热或者加入浓碘水。


科目:高中化学 来源: 题型:
【题目】选择一种容积将溴水中的溴萃取出来,这种溶剂应该具有的性质
A.易溶于水,且不与溴发生反应 B.不溶于水,且密度必须比水小
C.不溶于水,且密度必须比水大 D.不溶于水,且比水更容易使溴溶解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某温度下,Ka(HCN)=6.2×10-10mol·L-1、Ka(HF)=6.8×10-4mol·L-1、Ka(CH3COOH)=1.8×10-5mol·L-1、Ka(HNO2)=6.4×10-6mol·L-1。物质的量浓度都为0.1 mol·L-1的下列溶液中,pH最小的是
A. HCN溶液 B. HF溶液 C. CH3COOH溶液 D. HNO2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的能量变化与其他三项不相同的是( )
A. 铝粉与氧化铁的反应 B. 氯化铵与Ba(OH)2 ·8H2O的反应
C. 锌片与稀硫酸反应 D. 钠与冷水反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有以下混合液体: ①汽油和氯化钠溶液 ②乙醇与水 ③氯化钠溶液和单质溴,分离以上各混合液的正确方法依次是( )
A.分液、萃取、蒸馏
B.萃取、蒸馏、分液
C.分液、蒸馏、萃取
D.蒸馏、萃取、分液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中的离子,能在溶液中大量共存的是( )
A. Ba2+、Na+、OH-、SO42- B. Na+、H+、NO3-、CO32-
C. Mg2+、SO42-、K+、Cl- D. K+、Cu2+、Cl-、OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种物质中均含有同一种非金属元素,他们能发生如图所示的转化关系。若该元素用R表示,则A为R的氧化物,D与NaOH溶液反应生成C和H2。
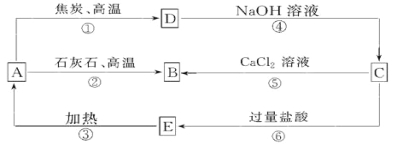
请回答:
(1)写出对应物质的化学式:A__________; C__________; E__________。
(2)反应①的化学方程式为: 。
(3)反应④的离子方程式为: 。
(4)H2CO3的酸性强于E的,请用离子方程式予以证明: _________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某酸性溶液中含有Ba2+、Fe3+,则下述离子组中能与上述离子共存的是( )。
A. CO32—、Cl— B. NO3—、Cl—
C. NO3—、SO42— D. OH—、NO3—
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com