
【题目】Al-Ag2O电池是水下大型机械常用电源,其工作原理如图所示。电池工作时,下列说法错误的是( )
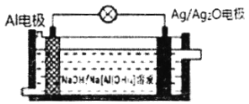
A.Al是电池的负极B.电池负极附近溶液pH升高
C.Al极反应式为: Al-3e- +4OH -==[AI(OH)4]-D.Ag/Ag2O 电极发生还原反应
科目:高中化学 来源: 题型:
【题目】教材插图是对教材内容高度概括的体现,也是为说明、理解、深化文字内容服务的。请回答下列问题:
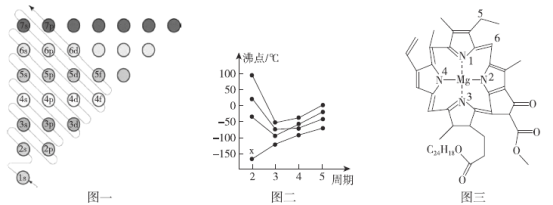
(1)图一为构造原理示意图,其含义是从H原子开始随着原子核电荷数递增,原子核每增加一个质子,核外便增加一个电子,电子大多按如图顺序填充。第四周期中,基态4s能级半充满的元素有___种,其中原子序数最大的基态原子的外围电子排布式为___。
(2)图二中,每条折线代表周期表中IVA-VIIA某一族元素简单氢化物的沸点变化,其他三条折线与x所在折线变化趋势不完全相同的原因为___;与x点对应的简单氢化物互为等电子体的离子为___(写一种)。
(3)图三为卟啉配合物叶绿素的结构示意图,1号N原子和3号N原子与Mg2+形成的化学键类型为___;5号C原子和6号C原子的杂化方式分别为___、___;该分子中所含非金属元素的电负性由小到大的顺序为___。
(4)从石墨晶体结构示意图中截取石墨的晶胞如图所示,设阿伏加德罗常数为NA,已知sin60°=![]() ),石墨晶体的密度为___g·cm-3(列出计算式)。
),石墨晶体的密度为___g·cm-3(列出计算式)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】检验并提取海带中碘的实验中涉及多种基本实验操作,下列相关叙述正确的是
A.灼烧海带时要用到蒸发皿、酒精灯等仪器
B.海带灰溶解和过滤的操作都要用到玻璃棒且作用不同
C.氧化I-时用浓硝酸代替稀硫酸和H2O2溶液效果更好
D.用CCl4萃取I2后要进行分液,有机层从分液漏斗上口倒出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z是原子序数依次增大的前四周期元素,W、Y在地壳中的含量处于前两位,X是周期表中电负性最大的元素,基态Z原子的价层电子数为8,下列说法正确的是
A.最高化合价:X>W>Y
B.Y与W、Y与X形成的二元化合物晶体类型相同
C.单质X在一定条件下能置换出单质W
D.Z与W两种元素形成的常见化合物均为黑色固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】奎宁酸和莽草酸是高等植物特有的脂环状有机酸常共存在一起,其结构简式如图所示。下列说法正确的是( )
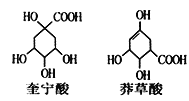
A. 奎宁酸与莽草酸互为同分异构体
B. 两种酸含有的官能团完全相同
C. 两种酸均能发生加成反应、聚合反应和取代反应
D. 等物质的量的两物质分别与足量Na反应,同温同压下产生H2的体积比为5:4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1) 一定温度下,发生反应: 2 SO2(g)+ O2 (g)![]() 2SO3(g)(反应条件己略),现向2L密闭容器中充入4.0 mol SO2和2.0 mol O2发生反应,测得n (O2) 随时间的变化如下表:
2SO3(g)(反应条件己略),现向2L密闭容器中充入4.0 mol SO2和2.0 mol O2发生反应,测得n (O2) 随时间的变化如下表:

①0~2 min内,v(SO2)=_______________
②达到平衡时SO3的物质的量浓度为____________
③下列可证明上述反应达到平衡状态的是____________(填序号)。
a. v(O2)=2v(SO3)
b. O2的物质的量浓度不再变化
c.每消耗1molO2,同时生成2molSO3
d.容器内压强保持不变
(2)已知可逆反应: 2NO2(g) (红棕色) ![]() N2O4(g) (无色),正反应为放热反应。将装有NO2和N2O4混合气体的烧瓶放入热水中,观察到的现象______________ ,产生该现象的原因是________________
N2O4(g) (无色),正反应为放热反应。将装有NO2和N2O4混合气体的烧瓶放入热水中,观察到的现象______________ ,产生该现象的原因是________________
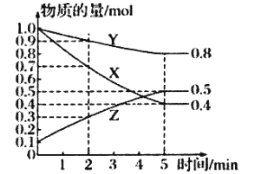
(3)某温度下的密闭容器中,X、Y、Z三种气体的物质的量随时间变化曲线如图,则该反应的化学方程式为_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铜矿是工业炼铜的原料,含有的主要元素是硫、铁、铜。请回答下列问题。
(1)Fe2+的电子排布式是____________________________。
(2)液态SO2可发生自偶电离![]() ,SO2属于_____________(选填“极性分子”或“非极性分子”),
,SO2属于_____________(选填“极性分子”或“非极性分子”),![]() 的空间构型是___________________。
的空间构型是___________________。
(3)范德华力可分为色散力、诱导力和取向力三类,其中取向力只存在于极性分子和极性分子之间,则H2S的水溶液中存在的取向力有_______种。
(4)乙硫醇(C2H5SH)是一种重要的合成中间体,分子中硫原子的杂化形式是____________。乙硫醇的沸点比乙醇的沸点低,原因是___________。
(5)黄铜矿主要成分X的晶胞结构及晶胞参数如图所示,X的化学式是______________,其密度为_____________g/cm3(阿伏加德罗常数的值用NA表示)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在锌与稀硫酸制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)上述实验中发生反应的离子方程式有________________________ 、 ________________________
(2)下图表示一定量的锌与足量的稀硫酸反应生成氢气的关系,若在反应液中加入少量硫酸铜固体,请在下图中用虚线表示这一关系。____________________
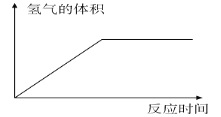
(3)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验,将表中的混合溶液分别加入到六个盛有过量锌粒的反应瓶中,收集产生氢气,记录获得相同体积的氢气所需的时间。
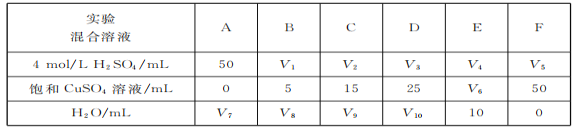
请完成此实验设计,其中:V2=_______ ,V6=_____________,V8=______________
该同学最后得出的结论为:当加入少量硫酸铜溶液时生成氢气的速率会大大提高,但当加入的硫酸铜溶液超过一定量时,生成氢气的速率反而会下降,请分析氢气生成速率下降的主要原因:______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】盐酸罗替戈汀是一种用于治疗帕金森病的药物,其合成路线流程图如下:
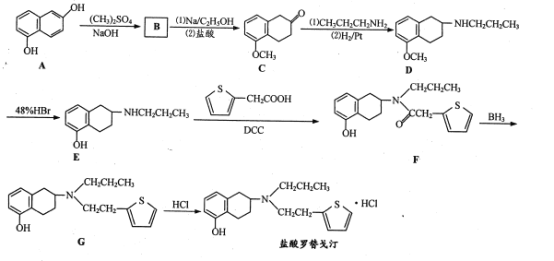
(1) 、CH3CH2CH2NH2中所含官能团的名称分别为 ______、 ________。
、CH3CH2CH2NH2中所含官能团的名称分别为 ______、 ________。
(2)D→E的反应类型是_______。
(3)B的分子式为C12H12O2,写出B的结构简式;____ 。
(4)C的一种同分异构体X同时满足下列条件,写出X的结构简式:_______。
①含有苯环,能使溴水褪色;
②能在酸性条件下发生水解,水解产物分子中所含碳原子数之比为6:5,其中一种水解产物分子中含有3种不同化学环境的氢原子。
(5)已知:![]()
![]() R3COOH+
R3COOH+![]() ,写出以
,写出以![]() 和
和![]() 为原料制备
为原料制备 的合成路线流程图_______(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。
的合成路线流程图_______(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com