
研究氧化还应常用到高锰酸钾,高锰酸钾是一种重要的化学试剂。为了增强其氧化性常将其酸化,但在酸性条件下其水溶液不很稳定,会分解生成二氧化锰和氧气,而在中性或弱碱性溶液中分解速度很慢,见光分解速度加快。
(1)高锰酸钾溶液保存的注意事项______________________________________________。
酸性溶液中高锰酸钾分解的离子方程式 _______________________________________。
(2)草酸可使酸性高锰酸钾溶掖褪色,请写出此反应的离子方程式______________________。
(3)某学习小组为了探究高锰酸钾溶液和草酸钠溶液的反应过程,将高锰酸钾溶液逐滴地滴入一定体积的酸性草酸钠溶液中(温度相同,并不断振荡时),记录的现象如下表:
| 滴入 KMnO4认溶液的次序(每滴溶液等体积) | KMnO4溶液紫色褪去的时间 |
| 先滴入第 1 滴 | 1min |
| 褪色后再滴入第 2 滴 | 15s |
| 褪色后再滴入第 3 滴 | 3s |
| 褪色后再滴入第 4 滴 | 1s |

(1)配成中性溶液并保存在棕色试剂瓶中避光保存;4MnO4-+4H+= MnO2+3O2↑+2H2O
(2) 2MnO4-+5H2C2O4+6H+= 2Mn2++10CO2↑+8H2O
(3)反应生成的Mn2+对反应又催化作用,且浓度大催化效果更好;
(4)①丙
② 逐滴滴入高锰酸钾溶液,待前一滴溶液褪色后再滴加,防止应反应不及时导致分解;
③0.0200mol/L
解析试题分析:(1)在酸性条件下其水溶液不很稳定,会分解生成二氧化锰和氧气,而在中性或弱碱性溶液中分解速度很慢,见光分解速度加快。所以保存高锰酸钾应配成中性溶液并保存在棕色试剂瓶中避光保存;4MnO4-+4H+= MnO2+3O2↑+2H2O
(2)2MnO4-+5H2C2O4+6H+= 2Mn2++10CO2↑+8H2O
(3)反应体系温度不变,但反应速率加快,故是反应产生催化剂所致,反应生成的Mn2+对反应又催化作用,且浓度大催化效果更好;(4)高锰酸钾溶液为氧化性溶液,应盛放在酸性滴定管中;逐滴滴入高锰酸钾溶液,待前一滴溶液褪色后再滴加,防止应反应不及时导致分解;
考点:考查氧化还原反应滴定有关问题。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
钒具有众多优异的性能,用途十分广泛,有金属“维生素”之称。完成下列填空:
(1)将废钒催化剂(主要成分V2O5)与稀硫酸、亚硫酸钾溶液混合,充分反应,所得溶液显酸性、含VO2+、K+、SO42–等。写出该反应的化学方程式 。
(2)向上述所得溶液中加入KClO3溶液,充分反应后,溶液中新增加了VO2+、Cl–。写出并配平该反应的离子方程式,并标出电子转移的数目和方向 。
(3)在20.00mL的0.1mol/LVO2+溶液中,加入0.195g锌粉,恰好完成反应,则还原产物可能是 。
a.V b.V2+ c.VO2+ d.VO2+
(4)已知V2O5能和盐酸反应生成氯气和VO2+。请再写一个离子反应方程式,说明还原性:SO32–>Cl–>VO2+ 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(14分)2013年6月,我国“蛟龙”号再次刷新“中国深度”——下潜7062米,为我国深海矿物资源的开发奠定了基础。海洋深处有丰富的锰结核矿,锰结核的主要成分是MnO2,同时还含有黄铜矿。
Ⅰ、“蛟龙”号外壳是用特殊的钛合金材料制成,它可以在7000m的深海中承受重压,Ti是以钛白粉(TiO2)为原料进行生产,钛白粉是利用TiO2+发生水解生成钛酸(H2TiO3)沉淀,再煅烧沉淀制得的。TiO2+发生水解的离子方程式为____________________________。
Ⅱ、MnO2是一种重要的无机功能材料,工业上从锰结核中制取纯净的MnO2工艺流程如下图所示: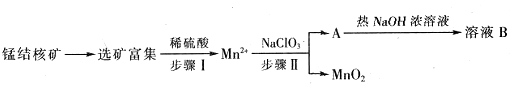
(1)步骤Ⅱ中以NaClO3为氧化剂,当生成0.05molMnO2时,消耗0.1mol/L的NaClO3溶液200ml,该反应离子方程式为_______________________________。
(2)已知溶液B的溶质之一可循环用于上述生产,此物质的名称是____________。
Ⅲ、利用黄铜矿炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3等)可制备Fe2O3,方法为:
(A)用过量的稀盐酸浸取炉渣、过滤;(B)向滤液中加入5%的H2O2,再向其中加入过量的NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得到Fe2O3。根据以上信息回答下列问题:
(1)(B)中向滤液中加入5%的H2O2,其目的是_________________________________。
(2)设计实验证明炉渣中含有FeO___________________________________________。
(3)将煅烧得到的Fe2O3还原为Fe单质,再将质量为m g的Fe单质分成相等的四份,分别与50mL、100mL、150mL、200mL的等浓度的稀硝酸反应,反应产物NO在标况下的体积见附表:
| 实验 | ① | ② | ③ | ④ |
| V(HNO3)/ml | 50 | 100 | 150 | 200 |
| V(NO)/L | 1.344 | 2.688 | 3.36 | 3.36 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
证明卤族元素的非金属性强弱,某小组用下图所示装置进行实验(夹持仪器已略去,气密性已检查)。
实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.当B中溶液由黄色变为棕红色时,关闭活塞a。
Ⅳ.……
(1)验证氯气的氧化性强于碘的实验现象是______________________________。
(2)B中溶液发生反应的离子方程式是______________________________。
(3)为验证溴的氧化性强于碘,过程 Ⅳ 的操作和现象是________________________________________。
(4)过程Ⅲ实验的目的是__________________________________________________。
(5)氯、溴、碘单质的氧化性逐渐减弱的原因:同主族元素从上到下,原子半径逐渐 ,得电子能力逐渐______。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某化学小组在学习元素周期律知识后,对教材中Cl2将Fe2+氧化成Fe3+的实验进一步思考,并提出问题:Cl2能将Fe2+氧化成Fe3+,那么Br2和I2能否将Fe2+氧化成Fe3+?
环节一:理论推测。
部分同学认为Br2和I2都能将Fe2+氧化成Fe3+,依据是____________________
_________________________________________________________________。
部分同学认为Br2和I2都不能将Fe2+氧化成Fe3+。还有同学认为Br2能将
Fe2+氧化成Fe3+,而I2不能,依据是同一主族从上到下卤素单质的氧化性逐渐减弱。
环节二:设计实验进行验证。
向大试管中加入适量铁粉,加入10 mL稀盐酸,振荡试管,充分反应后,铁粉有剩余,取上层清液进行下列实验。
实验1:
| 试管 | 操作 | 现象 |
| ① | 先向试管中加入2 mL新制的FeCl2溶液,再向试管中滴加少量红棕色的溴水,振荡试管 | 溶液为 黄色 |
| ② | 先向试管中加入2 mL新制的FeCl2溶液,再向试管中滴加少量棕黄色的碘水,振荡试管 | 溶液为 黄色 |
| 操作 | 现象 |
| | |
| 操作 | 现象 |
| 向试管②所得的溶液中继续加入0.5 mL CCl4,充分振荡,静置一段时间。取出上层溶液,滴加KSCN溶液 | 静置后,上层溶液几乎无色,下层溶液为紫色;取上层溶液滴加KSCN溶液后,溶液呈浅红色 |
| 操作 | 现象 |
| 向另一支试管中加入2 mL新制的FeCl2溶液,滴加0.5 mL碘水后,再加入0.5 mL乙酸乙酯,充分振荡,静置一段时间。取出下层溶液,滴加KSCN溶液 | 静置后,上层溶液为紫色,下层溶液几乎无色;取下层溶液,向其中滴加KSCN溶液后,溶液没有呈浅红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某研究小组为探究SO2和Fe(NO3)3溶液的反应的实质。设计了如下图所示装置进行实验.
已知:1.0 mol/L的Fe(NO3)3溶液的pH=1。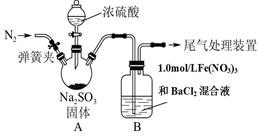
请回答:
(1)装置A中用于添加浓硫酸的仪器名称为 。
(2)实验前鼓入N2的目的是 。
(3)装置B中产生了白色沉淀,其成分是________,说明SO2具有________性。
(4)分析B中产生白色沉淀的原因。
观点1:SO2与Fe3+反应;
观点2:在酸性条件下SO2与NO3-反应;
①若观点1正确,除产生沉淀外,还应观察到的现象是 。
②按观点2,装置B中反应的离子方程式是 ,
③有人认为,如将装置B中的Fe(NO3)3溶液替换为等体积的下列溶液,在相同条件下进行实验,也可验证观点2是否正确。此时应选择的最佳试剂是(填序号) 。
| A.1 mol/L稀硝酸 |
| B.1.5 mol/L Fe(NO3)2溶液 |
| C.6.0 mol/L NaNO3溶液和0.2 mol/L盐酸等体积混合的溶液 |
| D.3.0 mol/L NaNO3溶液和0.1mol/L硫酸等体积混合的溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
碘是人体必需的微量元素之一,有“智力元素”之称。食用加碘食盐可预防碘缺乏病。查阅资料知:①在酸性条件下,I—能被NO3-离子氧化成IO3-离子,被H2O2或O2等氧化成I2;②IO3-离子能被HSO3-离子还原成I2。
请你利用实验室常用仪器和下列限选试剂,依次研究某食盐样品中所加碘的存在形式是I2、I-、IO3-中的哪一种。
限选试剂如下:1.0 mol?L-1HNO3溶液、1.0 mol?L-1 H2SO4溶液、1.0 mol?L-1NaHSO3溶液、3% H2O2溶液、1%淀粉溶液、蒸馏水
Ⅰ.提出假设
假设1:该食盐样品中含I2 ;
假设2:该食盐样品中含I—
假设3: 。
Ⅱ.设计方案与实验探究
将适量食盐样品溶于蒸馏水制成溶液,请按要求填写下表
| 实验步骤 | 预期现象与结论 |
| 步骤1:取少量上述溶液注入试管中,滴入几滴淀粉溶液振荡。 | 若溶液显 ,则假设1成立;否则,假设1不成立,再进行步骤2 |
| 步骤2: | 若溶液显蓝色,则假设2成立,反应的离子方程式为 ;否则,假设2不成立,再进行步骤3 |
| 步骤3: | |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
海水提镁的主要流程如下: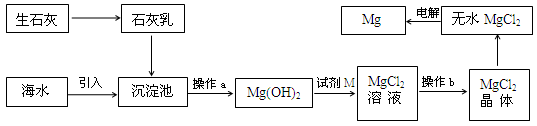
下列说法正确的是
①试剂M是盐酸 ②流程中的反应全部都是非氧化还原反应
③操作b只是过滤 ④用海水晒盐后的饱和溶液加石灰乳制Mg(OH)2
⑤电解熔融MgCl2比电解熔融的MgO制金属镁更节约能量
| A.①②③④⑤ | B.②③ | C.④⑤ | D.①④⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com