
| A. | 反应过程中可以看到白色沉淀先转化为灰绿色后转化为红褐色 | |
| B. | 若Fe2+失去4mol电子,生成氧气的体积在标准状况下约为22.4L | |
| C. | 4 mol Na2O2在反应中共得到6NA个电子 | |
| D. | 该反应中Na2O2既是氧化剂又是还原剂,O2是氧化产物 |
分析 A.Fe2+被Na2O2氧化生成Fe(OH)3;
B.若Fe2+失去4mol电子,则参加反应得到Fe2+为4mol,可知生成的氧气为1mol;
C.过氧化钠中氧元素化合价从-1价升高到0价,降低到-2价,4mol过氧化钠有1mol做还原剂,3mol做氧化剂;
D.Fe元素的化合价由+2价升高为+3价,过氧化钠中O元素的化合价由-1价升高为0,由-1价降低为-2价.
解答 解:A.Fe2+氧化生成Fe(OH)3,反应直接生成红褐色沉淀,所以反应过程中看不到白色沉淀转化为灰绿色再转化为红褐色沉淀的现象,故A错误;
B.若Fe2+失去4mol电子,则参加反应得到Fe2+为4mol,可知生成的氧气为1mol,则生成氧气的体积在标准状况下约为22.4L,故B正确误;
C.过氧化钠中氧元素化合价从-1价升高到0价,降低到-2价,4mol过氧化钠有1mol做还原剂,3mol做氧化剂,Na2O2在反应中得到电子6mol电子,即得到6NA个电子,故C正确;
D.Fe元素的化合价由+2价升高为+3价,过氧化钠中O元素的化合价由-1价升高为0,由-1价降低为-2价,反应中Na2O2既是氧化剂又是还原剂,O2是氧化产物,故D正确,
故选:A.
点评 本题考查氧化还原反应,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应中基本概念和转移电子数的考查,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H2 | B. | C2H4 | C. | C3H4 | D. | C6H6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
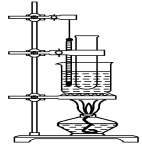
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
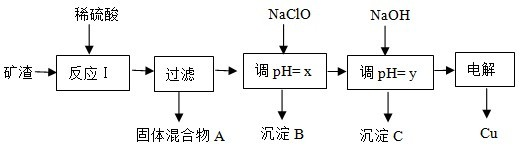
| 沉淀 | Cu(OH)2 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀pH | 5.4 | 4.0 | 2.2 | 5.8 |
| 沉淀完成pH | 6.7 | 5.2 | 3.2 | 8.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

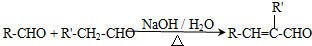
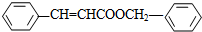 .
. .
.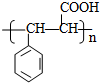 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  将NO2球浸泡在冷水和热水中 | |||||||||
| B. |
| |||||||||
| C. |
| |||||||||
| D. | 向SO2水溶液中滴加氯水后,溶液的pH值减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com