
| A、平衡向正反应方向移动 |
| B、混合气体的平均摩尔质量增大 |
| C、CO2的转化率增大 |
| D、正反应速率增大逆反应速率减小 |


科目:高中化学 来源: 题型:
 .现用如图装置制备环己酮(部分夹持仪器未画出):
.现用如图装置制备环己酮(部分夹持仪器未画出):
| 物质 | 相对分子质量 | 沸点(℃) | 密度(g?cm-3,20℃) | 溶解性 |
| 环己醇 | 100 | 161.1(97.8)* | 0.9624 | 微溶于水 |
| 环己酮 | 98 | 155.6(95)* | 0.9478 | 微溶于水 |
| 水 | 18 | 100.0 | 0.9982 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氢硫酸因含-2价的硫,所以只有还原性 |
| B、硫化氢气体通入硫酸亚铁中有黑色沉淀生成 |
| C、实验室制取硫酸氢时,可以用稀盐酸或稀硫酸,但不能用浓硫酸或硝酸 |
| D、氢硫酸溶液中加入镁粉会有氢气产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:
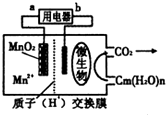
| A、电池工作时,电子由a流向b |
| B、微生物所在电极区放电时发生还原反应 |
| C、放电过程中,H+从正极区移向负极区 |
| D、正极反应式为:MnO2+4H++2e-═Mn2++2 H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
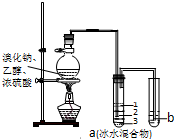 实验室制取少量溴乙烷的装置如图所示,将生成物导入盛有冰水混合物的试管a中,实验结束发现试管a中的物质分为三层.对该实验的分析错误的是( )
实验室制取少量溴乙烷的装置如图所示,将生成物导入盛有冰水混合物的试管a中,实验结束发现试管a中的物质分为三层.对该实验的分析错误的是( )| A、烧瓶中除发生取代反应可能发生消去反应、氧化还原反应等 |
| B、产物在a中第一层 |
| C、a中有产物和水还含HBr、CH3CH2OH等 |
| D、b中盛放的酸性KMnO4溶液会褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、该装置为电能转化为化学能的装置 |
| B、a电极发生的电极反应为CH3OH-6e-+H2O═CO2↑+6H+ |
| C、当电路中有1 mol e-转移时,正极区n(H+)增加1 mol |
| D、将酸性电解质溶液改为碱性电解质溶液该测试仪不可能产生电流 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 目的 | 操作 |
| A | 检验Fe2(SO4)3溶液中是否含有FeSO4 | 取少量溶液于试管,加入几滴0.1mol/L KMnO4溶液 |
| B | 证明Al(OH)3是两性氢氧化物 | 取Al(OH)3于试管A、B,分别滴加氨水与盐酸 |
| C | 比较S与P元素非金属性强弱 | 测定等浓度H2SO3、H3PO4的pH |
| D | 除去Na2CO3中的NaCl | 溶解,加入AgNO3溶液至不再产生沉淀,静置,过滤 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、稀的食盐水能杀死H7N9禽流感病毒 |
| B、煤经过分馏和干馏两个物理变化,可变为清洁能源 |
| C、电镀厂的废水直接用来灌溉农田,可提高水的利用率 |
| D、用CO2合成聚碳酸酯可降解塑料,有利于减少白色污染 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com