
| A. | H2O | B. | MgCl2 | C. | NaOH | D. | CH3COOH |
科目:高中化学 来源: 题型:选择题
| A. | 液氨汽化时吸热,可作制冷剂 | |
| B. | 氧化铝熔点高,可作耐火材料 | |
| C. | 利用酒精沸点较低,可作消毒杀菌剂 | |
| D. | 利用CO2合成的聚碳酸酯能水解,可作降解塑料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
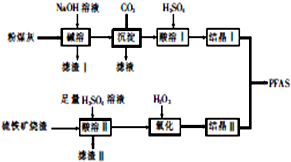 聚合硫酸铝铁[AlaFeb(OH)m(SO4)n•xH2O,简称PFAS]是一种新型高效水处理剂,以硫铁矿烧渣(主要成分为Fe3O4、FeO、SiO2等)和粉煤灰(主要成分为Al2O3、Fe2O3、FeO等)为主要原料制备PFAS的工艺流程如下:
聚合硫酸铝铁[AlaFeb(OH)m(SO4)n•xH2O,简称PFAS]是一种新型高效水处理剂,以硫铁矿烧渣(主要成分为Fe3O4、FeO、SiO2等)和粉煤灰(主要成分为Al2O3、Fe2O3、FeO等)为主要原料制备PFAS的工艺流程如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧燃料电池可将热能直接转变为电能 | |
| B. | 燃料电池的能量转化率可达100% | |
| C. | 氢氧燃料电池工作时氢气在正极被氧化 | |
| D. | 以KOH溶液为电解质溶液的氢氧燃料电池,正极反应为O2+2H2O+4e-=4OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
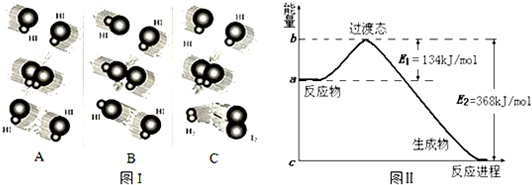
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2 L 0.1 mol•L-1的AlCl3溶液 | B. | 1 L 0.1 mol•L-1的FeCl2溶液 | ||
| C. | 1 L 1 mol•L-1的NaCl溶液 | D. | 1 L 2 mol•L-1的KClO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水加热到很高的温度都难以分解 | |
| B. | 水结成冰体积膨胀,密度变小 | |
| C. | 水分解成氢气和氧气吸收热量 | |
| D. | HF、HCl、HBr、HI的热稳定性依次减弱 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com