
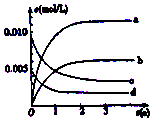
 800℃在2L密闭容器内,充入0.020molNO与0.010mol的O2,发生反应2NO(g)+O2(g)?2NO2(g) n(NO)随时间的变化如表:( )
800℃在2L密闭容器内,充入0.020molNO与0.010mol的O2,发生反应2NO(g)+O2(g)?2NO2(g) n(NO)随时间的变化如表:( )| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO) (mol) | 0.020 | 0.010 | 0.009 | 0.008 | 0.008 | 0.008 |
| A. | a线表示NO2的变化趋势,则0~2s内v(NO2)=0.006mol/(L•s) | |
| B. | 800℃时,该反应的平衡常数K=1125L/mol | |
| C. | 能使该反应的反应速率增大,且平衡向正方向移动的措施是及时分理出NO2 | |
| D. | 已知:K300℃>K350℃,则该反应时吸热反应 |
分析 由表中数据可知反应为3s时NO的物质的量不变,说明达到平衡状态.
2NO(g)+O2(g)?2NO2(g)
起始(mol) 0.02 0.01 0
转化(mol) 0.012 0.006 0.012
平衡(mol)0.008 0.004 0.012
根据数据的变化可确定各物质的变化曲线,并以此确定平衡常数,以此解答该题.
解答 解:由表中数据可知反应为3s时NO的物质的量不变,说明达到平衡状态.
2NO(g)+O2(g)?2NO2(g)
起始(mol) 0.02 0.01 0
转化(mol) 0.012 0.006 0.012
平衡(mol)0.008 0.004 0.012
A.二氧化氮为生成物,由以上计算可知达到平衡时物质的量为0.012,浓度为0.006ol/L,则b线表示NO2的变化趋势,故A错误;
B.体积为2L,则800℃时,该反应的平衡常数K=$\frac{0.00{6}^{2}}{0.00{4}^{2}×0.002}$=1125,故B正确;
C.分理出NO2,浓度减小,则反应速率减小,故C错误;
D.K300℃>K350℃,说明升高温度平衡逆向移动,则正反应为放热反应,故D错误.
故选B.
点评 本题考查化学平衡的计算,为高频考点,侧重考查学生的分析能力和计算能力,注意把握表中数据的分析以及曲线的变化,难度不大.


 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:解答题
 硫及其化合物广泛分布于自然界中,硫酸工业在国民经济中占有极其重要的地位,运用相关原理回答下列问题:
硫及其化合物广泛分布于自然界中,硫酸工业在国民经济中占有极其重要的地位,运用相关原理回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
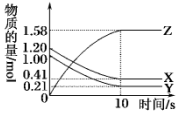 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示.下列描述正确的是( )
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示.下列描述正确的是( )| A. | 反应开始到10 s,用X表示的反应速率为0.158 mol•L-1•s-1 | |
| B. | 反应开始到10 s,Y的物质的量浓度减少了0.79 mol•L-1 | |
| C. | 反应10s时达到化学平衡状态,Z的平衡浓度为0.79 mol•L-1 | |
| D. | 反应的化学方程式为2X(g)+2Y(g)?Z(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=7的溶液中:Al3+、K+、SO42-、HCO3- | |
| B. | FeCl2溶液中:SO42-、H+、MnO4-、Na+ | |
| C. | 水电离的c (H+)=1×10-13 mol•L-1:S2-、SO32-、S2O32-、SO42- | |
| D. | 滴加甲基橙试剂显红色的溶液中:Na+、NH4+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HNO2不跟NaCl反应 | |
| B. | NaNO2溶液的pH大于7 | |
| C. | 常温下0.lmol/L HNO2溶液的pH为2.145 | |
| D. | 相同温度下,用相同浓度的HCl溶液和HNO2溶液作导电试验,HNO2溶液灯泡较暗 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④ | B. | ①②④ | C. | ①③⑤ | D. | ②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应前后气体的压强之比为4:3 | |
| B. | 反应前后气体的密度之比为l5:16 | |
| C. | H2与CO的转化率相等,均为50% | |
| D. | 若H2与CO按8:5体积比混合,则反应前后混合气体的平均相对分子质量不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①⑤ | B. | ③④⑤ | C. | ①④⑥ | D. | ①②③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com