
| A. | Mg2+/Mg | B. | K+/S2- | C. | N/P | D. | Cl-/Cl |
分析 A.同种元素的阳离子半径小于原子半径;
B.电子层结构相同的离子,核电荷数越大离子半径越小;
C.同主族自上而下原子半径增大;
D.同种元素的阴离子半径大于原子半径.
解答 解:A.同种元素的阳离子半径小于原子半径,故Mg2+/Mg比值小于1,故A错误;
B.电子层结构相同的离子,核电荷数越大离子半径越小,故K+/S2-比值小于1,故B错误;
C.同主族自上而下原子半径增大,故N/P比值小于1,故C错误;
D.同种元素的阴离子半径大于原子半径,故Cl-/Cl比值大于1,故D正确,
故选:D.
点评 本题考查微粒半径的比较,明确原子半径的比较方法、离子半径与原子半径的关系即可解答,题目难度不大.


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:解答题

 ,无水HF的作用是反应物和溶剂
,无水HF的作用是反应物和溶剂查看答案和解析>>
科目:高中化学 来源: 题型:解答题
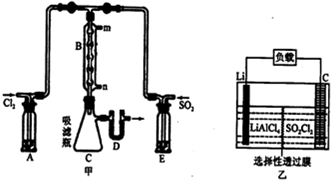
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
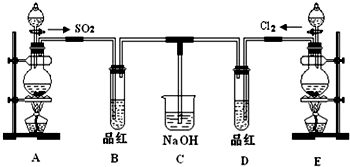
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜与盐酸反应:Cu+2H+═Cu2++H2↑ | |
| B. | 硫酸与氯化钡溶液反应:Ba2++SO42-═BaSO4↓ | |
| C. | 金属钠与水反应:2Na+2H+═2Na++H2↑ | |
| D. | 氯化亚铁与氯水反应:Fe2++Cl2═Fe3++2Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 少量H2S通入NaOH溶液中;足量H2S通入NaOH溶液中 | |
| B. | 少量铁粉与硫粉共热;足量铁粉与硫粉共热 | |
| C. | 常温下Na与O2反应;Na在O2中点燃 | |
| D. | 铜与稀硝酸反应;铜与浓硝酸反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO与NOx反应的化学方程式是:2x CO+2 NOx=2x CO2+N2 | |
| B. | CO与NOx反应中还原剂为NOx | |
| C. | 安装催化转换器处理汽车尾气的缺点是在一定程度上提高了空气的酸度 | |
| D. | 汽车改用天然气或氢气为燃料,都会减少对空气的污染 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com