
| A. | 甲烷和乙烯 | B. | 甲烷和丙烯 | C. | 乙烷和乙烯 | D. | 甲烷和丁烯 |
分析 根据混合气体的密度是相同状况下H2密度的11.2倍可以确定有机物的平均摩尔质量22.4g/mol,故混合气体中一定有甲烷,混合气体的总的物质的量为:$\frac{18g}{22.4g/mol}$=0.8mol;该混合气通过Br2水时,Br2水增重8.4g,8.4g为烯烃的质量,所以甲烷的质量为9.6g,物质的量为0.6mol,故烯烃的物质的量为0.2mol,结合烯烃的质量和物质的量来确定烯烃的摩尔质量,再根据烯烃组成通式确定烯烃.
解答 解:混合气体的密度是相同状况下H2密度的11.2倍可以确定有机物的平均摩尔质量22.4g/mol,故混合气体中一定有甲烷,混合气体的总的物质的量为:$\frac{18g}{22.4g/mol}$=0.8mol;该混合气通过Br2水时,Br2水增重8.4g,8.4g为烯烃的质量,所以甲烷的质量为9.6g,物质的量为0.6mol,故烯烃的物质的量为0.2mol,所以M(烯烃)=$\frac{8.4g}{0.2mol}$=42g•mol-1,
设烯烃的组成为CnH2n,则:14n=42,解得:n=3,故该烯烃为丙烯,
所以该混合物为甲烷、丙烯,
故选B.
点评 本题考查混合物反应的计算、有机物分子式的确定,题目难度中等,根据平均摩尔质量确定含有甲烷是解题的关键,试题培养了学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:选择题
| A. | 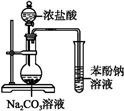 证明酸性:盐酸>碳酸>苯酚 | B. |  实验室制取乙酸乙酯 | ||
| C. |  石油分馏 | D. |  实验室制取硝基苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2,3-二甲基丁烷和2-甲基丁烷 | B. | 戊烷和环己烷 | ||
| C. | 丙烷和2-甲基丙烷 | D. | 2,3-二甲基丁烷和和己烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


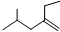 的系统命名4-甲基-2-乙基-1-戊烯
的系统命名4-甲基-2-乙基-1-戊烯查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | ⑥ | ⑦ | ||||||
| 3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
| 4 | ② | ④ | ⑨ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢化钙是一种强氧化剂 | |
| B. | 加热时,氢化钙能跟干燥氧气反应生成水 | |
| C. | 氢化钙(CaH2)是离子化合物,固体中含H-H键 | |
| D. | 可以取少量试样滴加几滴水,检验反应是否产生氢气来区别金属钙与氢化钙 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com