
| 元素 | 相关信息 |
| A | 原子核外L层电子数是K层的2倍 |
| B | 其一种单质被称为地球生物的“保护伞” |
| C | 元素的第一电离能是第3周期所有元素中最小的 |
| D | 基态原子最外层电子排布为(n+1)sn(n+1)p(n+2) |
| E | 可形成多种氧化物,其中一种为具有磁性的黑色晶体 |
分析 A元素原子核外L层电子数是K层的2倍,则L层有4个电子,故A为碳元素;B元素的一种单质被称为地球生物的“保护伞”,故B为氧元素;C元素的第一电离能是第3周期所有元素中最小的,故C为Na元素;D元素基态原子最外层电子排布为(n+1)sn(n+1)p(n+2),由于n=2,故D为S元素;E元素可形成多种氧化物,其中一种为具有磁性的黑色晶体,故E为Fe元素,据此解答.
解答 解:A元素原子核外L层电子数是K层的2倍,则L层有4个电子,故A为碳元素;B元素的一种单质被称为地球生物的“保护伞”,故B为氧元素;C元素的第一电离能是第3周期所有元素中最小的,故C为Na元素;D元素基态原子最外层电子排布为(n+1)sn(n+1)p(n+2),由于n=2,故D为S元素;E元素可形成多种氧化物,其中一种为具有磁性的黑色晶体,故E为Fe元素.
(1)C为Na元素,处于周期表中第三周期IA族,D为硫元素,基态原子核外电子排布式是1s22s22p63s23p4,
故答案为:三、IA;1s22s22p63s23p4;
(2)B、C、D的简单离子分别为O2-、Na+、S2-,电子层排布相同,核电荷数越大离子半径越小,最外层电子数相同,电子层越多离子半径越大,故离子半径由大到小的顺序为:S2->O2->Na+,
由于非金属性O>S,故气态氢化物中稳定性H2O>H2S,
故答案为:S2->O2->Na+;H2O;
(3)B、C的单质按物质的量比1:2形成的化合物为Na2O2,含有离子键、共价键,属于离子晶体,
故答案为:离子键、共价键;离子;
(4)E的黑色磁性晶体为Fe3O4,发生铝热反应的化学方程式是:3Fe3O4+8Al$\frac{\underline{\;高温\;}}{\;}$9Fe+4Al2O3,
故答案为:3Fe3O4+8Al$\frac{\underline{\;高温\;}}{\;}$9Fe+4Al2O3.
点评 本题考查结构性质位置关系、核外电子排布规律、微粒半径比较、化学键等,难度不大,旨在考查学生对基础知识的全面掌握.


科目:高中化学 来源: 题型:选择题
| A. | 加H2O | B. | 加入饱和食盐水 | ||
| C. | 增大压强 | D. | 升高温度(不考虑盐酸挥发) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg | B. | $\frac{1}{M}$g | C. | $\frac{M}{6.02×1{0}^{23}}$g | D. | $\frac{6.02×1{0}^{23}}{\;}$g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ,M的化学式为FeS,F的电子式为
,M的化学式为FeS,F的电子式为 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 冰醋酸、纯碱、芒硝、生石灰分别属于酸、碱、盐、氧化物 | |
| B. | HClO、H2SO4(浓)、HNO3均具有强氧化性,都是氧化性酸 | |
| C. | 漂白粉、福尔马林、冰水、王水、氯水均为混合物 | |
| D. | Na2O,NaOH,Na2CO3,NaCl,Na2SO4,Na2O2都属于钠的含氧化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
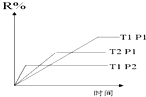
| A. | 正反应吸热,L是气体 | B. | 正反应吸热,L是固体 | ||
| C. | 正反应放热,L是气体 | D. | 正反应放热,L是固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氧化亚铜(Cu2O)作为一种重要的无机化工原料,在涂料、有色玻璃和催化剂等领域有着广泛的用途.回答下列问题:
氧化亚铜(Cu2O)作为一种重要的无机化工原料,在涂料、有色玻璃和催化剂等领域有着广泛的用途.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H4、C2H2 | B. | CH4、C2H6 | C. | CH4、C2H4 | D. | C2H2、C3H6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 向100mLBaCl2、AlCl3、FeCl3 的混合溶液A中逐滴加入Na2SO4和NaOH的混合溶液B,产生沉淀的物质的量n和加入溶液B的体积关系如图所示:
向100mLBaCl2、AlCl3、FeCl3 的混合溶液A中逐滴加入Na2SO4和NaOH的混合溶液B,产生沉淀的物质的量n和加入溶液B的体积关系如图所示:| 溶质 | Na2SO4 | NaOH | BaCl2 | AlCl3 | FeCl3 |
| c/mol•L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com