
无水AlCl3易升华,可用作有机合成的催化剂等。工业上以铝土矿(Al2O3、Fe2O3)为原料制备无水AlCl3的工艺流程如下。
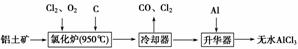
(1)氯化炉中Al2O3、Cl2和C反应的化学方程式为_____________________________
________________________________________________________________________。
(2)用Na2SO3溶液可除去冷却器排出的尾气中的Cl2,此反应的离子方程式为________________________________________________________________________。
(3)升华器中主要含有AlCl3和FeCl3,需加入少量Al,其作用是________________________________________________________________________。
(4)为测定制得的无水AlCl3产品(含杂质FeCl3)的纯度,称取16.25 g无水AlCl3样品,溶于过量的NaOH溶液中,过滤出沉淀物,沉淀物经洗涤、灼烧、冷却、称重,得其质量为0.32 g。
①写出上述除杂过程中涉及的离子方程式:______________________________、______________________________。
②AlCl3产品的纯度为__________。
(5)工业上另一种以铝灰为原料制备无水AlCl3的工艺中,最后一步是由AlCl3·6H2O脱水制备无水AlCl3,实现这一步的方法是________。
答案 (1)Al2O3+3Cl2+3C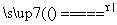 2AlCl3+3CO
2AlCl3+3CO
(2)SO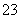 +Cl2+H2O===SO
+Cl2+H2O===SO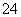 +2Cl-+2H+
+2Cl-+2H+
(3)除去FeCl3
(4)①Fe3++3OH-===Fe(OH)3↓ Al3++4OH-===[Al(OH)4]- ②96%
(5)在HCl气流中加热脱去结晶水
解析 (1)由经冷却器出来的气体有CO和Cl2可知,CO是氯化炉中的生成物,且Cl2是过量的,故氯化炉中发生反应的化学方程式为Al2O3+3Cl2+3C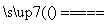 2AlCl3+3CO。(2)亚硫酸钠是还原剂,氯气是氧化剂,则离子方程式为SO
2AlCl3+3CO。(2)亚硫酸钠是还原剂,氯气是氧化剂,则离子方程式为SO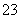 +Cl2+H2O===SO
+Cl2+H2O===SO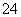 +2Cl-+2H+。(4)①除杂过程中涉及的离子方程式为Fe3++3OH-===Fe(OH)3↓,Al3++4OH-===[Al(OH)4]-。②沉淀物经洗涤、灼烧、冷却、称重得到的0.32 g固体物质是氧化铁,即0.002 mol,则氯化铁为0.004 mol,即0.65 g,得出AlCl3的质量为16.25 g-0.65 g=15.6 g,AlCl3的纯度为
+2Cl-+2H+。(4)①除杂过程中涉及的离子方程式为Fe3++3OH-===Fe(OH)3↓,Al3++4OH-===[Al(OH)4]-。②沉淀物经洗涤、灼烧、冷却、称重得到的0.32 g固体物质是氧化铁,即0.002 mol,则氯化铁为0.004 mol,即0.65 g,得出AlCl3的质量为16.25 g-0.65 g=15.6 g,AlCl3的纯度为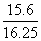 ×100%=96%。(5)由于氯化铝易水解,水解后生成的氯化氢气体挥发后,使水解平衡正向移动,生成大量的氢氧化铝,故为了抑制其水解,必须在氯化氢的气流中加热脱去结晶水。
×100%=96%。(5)由于氯化铝易水解,水解后生成的氯化氢气体挥发后,使水解平衡正向移动,生成大量的氢氧化铝,故为了抑制其水解,必须在氯化氢的气流中加热脱去结晶水。


科目:高中化学 来源: 题型:
书写电子式或用电子式回答下列问题
① NaOH ② Mg2+
③ O=C=O ④ CCl4
⑤用电子式表示H2O形成过程
⑥用电子式表示硫化钠形成过程
查看答案和解析>>
科目:高中化学 来源: 题型:
用含少量镁粉的铝粉制取纯净的氢氧化铝,下列操作步骤中最恰当的组合是 ( )
①加盐酸溶解 ②加烧碱溶液溶解 ③过滤 ④通入过量CO2生成Al(OH)3沉淀 ⑤加入盐酸生成Al(OH)3沉淀 ⑥加入过量烧碱溶液
A.①⑥⑤③ B.②③④③
C.②③⑤③ D.①③⑤③
查看答案和解析>>
科目:高中化学 来源: 题型:
近年来,科学家正在探索利用铝粉作为新能源的可能性,以期铝能成为一种石油的取代物。假如铝作为一种普遍使用的新型能源被开发利用,关于其有利因素的下列说法,你认为哪项是错误的 ( )
A.铝质轻,便于运输、贮存,且安全
B.铝燃烧时放出的热量大,且燃烧后产物对环境的污染容易得到有效的控制
C.在地球上,铝矿资源比较丰富
D.现代电冶铝的工业技术已为铝作为新能源奠定了重要基础
查看答案和解析>>
科目:高中化学 来源: 题型:
双羟基铝碳酸钠是医疗上常用的一种抑酸剂,其化学式是NaAl(OH)2CO3。关于该物质的说法正确的是 ( )
A.该物质属于两性氢氧化物
B.该物质是Al(OH)3和Na2CO3的混合物
C.1 mol NaAl(OH)2CO3最多可消耗3 mol H+
D.该药剂不适合于胃溃疡患者服用
查看答案和解析>>
科目:高中化学 来源: 题型:
下列排序不正确的是( )
A.还原性:HI > HBr > HCl > HF
B.晶体熔点:金刚石 > SiC > NaCl > Na > Mg > Al
C.酸性: HClO4 > H2SO4 > H2SO3 > HClO
D.晶格能: MgF2> NaCl > NaBr
查看答案和解析>>
科目:高中化学 来源: 题型:
医学上在进行胃肠疾病检查时,利用X射线对BaSO4穿透能力较差的特性,常用BaSO4做内服造影剂,这种检查手段称为钡餐透视。
Ⅰ.请写出BaSO4能作为钡餐透视的另外一个理由(从物质性质方面):________________________ 。
Ⅱ.某课外活动小组为探究BaSO4的溶解度,分别将足量BaSO4放入下列溶液中溶解至饱和:
①5 mL水
②20 mL 0.5 mol·L-1的Na2SO4溶液
③40 mL 0.2mol·L-1的Ba(OH)2溶液
④40 mL 0.1 mol·L-1的H2SO4溶液中,
(1) 以上各溶液中,c(Ba2+)的大小顺序正确的是 (选填序号,下同),BaSO4的溶解度大小顺序是
A.③>①>④>② B.③>①>②>④
C.①>④>③>② D.①>③>④>②
(2) 已知25℃时,Ksp(BaSO4)=1.1×10-10,上述溶液③中的c(SO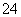 )为__________ mo1/L;
)为__________ mo1/L;
(3) 若将溶液③和溶液④直接混合,则混合溶液的pH为__________(假设混合后溶液的体积为混合前两溶液的体积之和)。
查看答案和解析>>
科目:高中化学 来源: 题型:
氯普鲁卡因盐酸盐是一种局部麻醉剂,麻醉作用较快、较强,毒性较低,其合成路线如下:
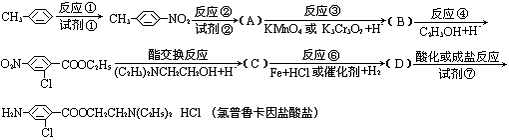
请把相应反应名称填入下表中,供选择的反应名称如下:
氧化、还原、硝化、氯代、酸化、酯化、水解
| 反应编号 | ① | ② | ③ | ④ | ⑥ |
| 反应名称 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com