
(1)在100℃时,PH=7呈 性.
(2)碳酸钠溶液呈碱性的原因,用离子方程式表示: .
(3)氯化铝溶液呈酸性的原因,用离子方程式表示:
(4)写电离方程式NaHCO3
(5)由氢气和氧气反应生成1mol水蒸气放热241.8KJ,写出该反应的热化学方程式: .
考点:
盐类水解的原理;电离方程式的书写;有关反应热的计算;水的电离.
分析:
(1)依据溶液中离子积常数可知,常温下Kw=10﹣14,升高温度促进水的电离,氢离子浓度增大,pH减小,中性溶液pH<7.
(2)碳酸钠为强碱弱酸盐,碳酸根离子水解而使其溶液呈碱性;
(3)氯化铝为强酸弱碱盐,铝离子水解导致溶液呈酸性;
(4)碳酸氢钠为强电解质,溶液中电离出钠离子和碳酸氢根离子;
(5)根据热化学方程式的书写原则写出氢气燃烧生成气态水的热化学方程式;
解答:
解:(1)常温下Kw=10﹣14,升高温度促进水的电离,氢离子浓度增大,pH减小,中性溶液pH<7,在100℃时,pH=7呈碱性,
故答案为:碱;
(2)碳酸钠为强碱弱酸盐,碳酸根离子水解而使其溶液呈碱性,水解方程式为CO32﹣+H2O⇌HCO3﹣+OH﹣,故答案为:CO32﹣+H2O⇌HCO3﹣+OH﹣;
(3)氯化铝为强酸弱碱盐,铝离子水解导致溶液呈酸性,水解方程式为Al3++3H3O⇌Al(OH)3+3H+,
故答案为:Al3++3H3O⇌Al(OH)3+3H+;
(4)碳酸氢钠属于强电解质,溶液中完全电离,碳酸氢钠的电离方程式为:NaHCO3═Na++HCO3﹣,
故答案为:NaHCO3═Na++HCO3﹣.
(5)氢气和氧气反应生成1mol水蒸气放热241.8kJ,该反应的热化学方程式为:H2(g)+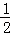 O2(g)═H2O(g)△H=﹣241.8kJ/mol,
O2(g)═H2O(g)△H=﹣241.8kJ/mol,
故答案为:H2(g)+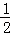 O2(g)═H2O(g)△H=﹣241.8kJ/mol;
O2(g)═H2O(g)△H=﹣241.8kJ/mol;
点评:
本题考查电离、水解及其热化学方程式的书写,难度不大,注意掌握热化学方程式的书写,物质聚集状态的分析判断,题目较简单.


科目:高中化学 来源: 题型:
1.00L 1.00mol•L﹣1 NaOH溶液与足量的稀盐酸反应,放出 57.4kJ的热量.表示该反应的中和热的热化学方程式正确的是( )
|
| A. | NaOH+HCl═NaCl+H2O△H=+57.4kJ•mol﹣1 |
|
| B. | NaOH+HCl═NaCl+H2O△H=﹣57.4 kJ•mol﹣1 |
|
| C. | NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=+57.4 kJ•mol﹣1 |
|
| D. | NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=﹣57.4 kJ•mol﹣1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组离子一定能大量共存的是( )
|
| A. | 在含大量Fe3+的溶液中:NH4+、Na+、Cl﹣、SCN﹣ |
|
| B. | 在强碱溶液中:Na+、K+、AlO2﹣、CO32﹣ |
|
| C. | 在c(H+)=10﹣13mol/L的溶液中:NH4+、Al3+、SO42﹣、NO3﹣ |
|
| D. | 在pH=0的溶液中:K+、Fe2+、Cl﹣、NO3﹣ |
查看答案和解析>>
科目:高中化学 来源: 题型:
如图表示温度、压强对下列平衡的影响:N2 (g)+3H2(g)⇌2NH3(g)△H<0图中y轴表示的意义是( )
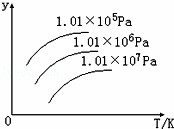
|
| A. | 正反应速率 |
|
| B. | 平衡混合气体中NH3的含量 |
|
| C. | 平衡混合气体中N2的物质的量 |
|
| D. | H2的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关化学用语使用不正确的是( )
|
| A. | 原子核内有18个中子的氯原子: |
|
| B. | S2﹣的结构示意图: |
|
| C. | 钒原子电子排布式:[Ar]3d34s2 |
|
| D. | NH4Br的电子式: |
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度下,体积一定的密闭容器中进行如下可逆反应:X(g)+Y(g)⇌Z(g)+W(s)△H>0.下列叙述正确的是( )
|
| A. | 加入少量W,逆反应速率增大 |
|
| B. | 当容器中气体压强不变时,反应达到平衡 |
|
| C. | 升高温度,平衡逆向移动 |
|
| D. | 平衡后加入X,上述反应的△H增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
用物质的量都是0.1 mol的CH3COOH和CH3COONa配制成1L混合溶液,已知其中c(CH3COO-)大于c(Na+)。对该混合溶液的下列判断正确的是
| A.c(OH-)>c(H+) | B.c(CH3COOH)+c(CH3COO-)=0.2 mol • L﹣1 |
| C.c(CH3COOH)>c(CH3COO- ) | D.c(CH3COO- )+c(OH- )=0.2 mol • L﹣1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
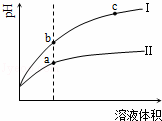
某温度下,相同pH值的盐酸和醋酸溶液分别加水稀释,平衡pH值随溶液体积变化的曲线如图所示.据图判断正确的是( )
|
| A. | Ⅱ为盐酸稀释时的pH值变化曲线 |
|
| B. | b点溶液的导电性比c点溶液的导电性强 |
|
| C. | a点Kw的数值比c点Kw的数值大 |
|
| D. | b点酸的总浓度大于a点酸的总浓度 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com