
【题目】某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、乙酸。

已知:①无水氯化钙可与乙醇形成微溶于水的CaCl2·6C2H5OH;
②有关有机物的沸点:
试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
沸点/℃ | 34.7 | 78.5 | 118 | 77.1 |
请回答:
(1)圆底烧瓶中发生的化学反应方程式:________,浓硫酸的作用为________。
(2)球形干燥管C的作用是_________,D中放________溶液,其作用是________。
(3)从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,分离出____________;再加入(此空从下列选项中选择)__________;然后进行蒸馏,收集77℃左右的馏分,以得到较纯净的乙酸乙酯。
A.生石灰B.碱石灰C.无水硫酸钠
【答案】CH3COOH+CH3CH2OH![]() CH3COOC2H5+H2O 催化剂和吸水剂 防止倒吸 饱和碳酸钠溶液 溶解乙醇,中和乙酸,降低乙酸乙酯的溶解度 乙醇 C
CH3COOC2H5+H2O 催化剂和吸水剂 防止倒吸 饱和碳酸钠溶液 溶解乙醇,中和乙酸,降低乙酸乙酯的溶解度 乙醇 C
【解析】
乙酸与乙醇在加热、浓硫酸作催化剂的条件下发生酯化反应生成乙酸乙酯,加热时乙醇和乙酸能挥发,混在乙酸乙酯中,常用饱和碳酸钠溶液吸收乙酸乙酯。
(1) 乙酸与乙醇在加热、浓硫酸作催化剂的条件下发生酯化反应生成乙酸乙酯,化学反应方程式为:CH3COOH + CH3CH2OH![]() CH3COOC2H5+ H2O;该反应为可逆反应,浓硫酸吸水利于平衡向生成乙酸乙酯方向移动,所以浓硫酸的作用为催化剂和吸水剂;
CH3COOC2H5+ H2O;该反应为可逆反应,浓硫酸吸水利于平衡向生成乙酸乙酯方向移动,所以浓硫酸的作用为催化剂和吸水剂;
(2) 烧瓶中出来的气体有乙酸、乙醇,它们易溶于水,球形干燥管的作用是防止倒吸;D中放饱和碳酸钠溶液,可以除去乙醇和乙酸,所以其作用是溶解乙醇,中和乙酸,降低乙酸乙酯的溶解度;
(3) 先加入无水氯化钙,根据信息氯化钙和乙醇能发生反应,生成微溶于水的物质,所以无水氯化钙能分离出乙醇;生石灰和碱石灰能生成碱,乙酸乙酯在碱性条件下水解,所以选择用无水硫酸钠除去少量的水,无水硫酸钠吸水形成硫酸钠结晶水合物。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】随着我国汽车年销量的大幅增加,空气环境受到了很大的污染。汽车尾气装置里,气体在催化剂表面吸附与解吸作用的过程如图所示,下列说法正确的是( )

A.反应中NO为氧化剂,N2为氧化产物
B.汽车尾气的主要污染成分包括CO、NO和N2
C.NO和O2必须在催化剂表面才能反应
D.催化转化总化学方程式为2NO+O2+4CO 4CO2+N2
4CO2+N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 是一种重要的化学原料,在生产和生活中应用十分广泛。
是一种重要的化学原料,在生产和生活中应用十分广泛。
(1)氯水中![]() 具有漂白性,能杀菌消毒。其电子式为_____________。
具有漂白性,能杀菌消毒。其电子式为_____________。
(2)实验室可用![]() 和浓盐酸反应制取
和浓盐酸反应制取![]() ,反应的离子方程式是_________。
,反应的离子方程式是_________。
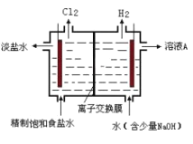
(3)工业上可采取电解饱和食盐水的方法制取![]() ,装置如图所示,图中的离子交换膜为_______(填“阳”或“阴”)离子交换膜。
,装置如图所示,图中的离子交换膜为_______(填“阳”或“阴”)离子交换膜。
(4)以![]() 为原料,用
为原料,用![]() 氧化制取
氧化制取![]() ,可提高效益,减少污染。反应如下:
,可提高效益,减少污染。反应如下:![]()
上述反应在同一反应器中,通过控制合适条件,分两步循环进行,可使![]() 转化率接近100%,其基本原理如下图所示:
转化率接近100%,其基本原理如下图所示:
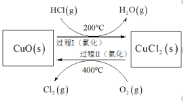
过程Ⅰ的反应为:![]()
![]()
①过程Ⅱ反应的热化学方程式为_______________。
②过程Ⅰ流出的气体通过稀![]() 溶液(含少量酚酞)进行检测,氯化初期主要为不含
溶液(含少量酚酞)进行检测,氯化初期主要为不含![]() 的气体,判断氯化结束时溶液的现象为___________。
的气体,判断氯化结束时溶液的现象为___________。
③相同条件下,若将氯化温度升高的300℃。溶液中出现上述现象的时间将缩短,其原因为______。
④实验测得在不同压强下,总反应的![]() 平衡转化率
平衡转化率![]() 随温度变化的曲线如图;
随温度变化的曲线如图;
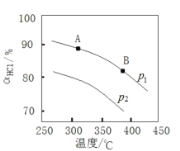
i 平衡常数比较:K(A)_________K(B)(填“>”“<”或“=”)。
ii 压强比较:p1_______p2 。(填“>”“<”或“=”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由乙烯和其他无机原料合成环状酯E和高分子化合物H的示意图如下所示:
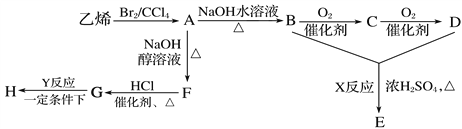
请回答下列问题:
(1)写出以下物质的结构简式:A______________,C_____________。
(2)写出以下物质的官能团名称:B__________,D_____________。
(3)写出以下反应的化学方程式:
A→B:______________________________________________________;
G→H:______________________________________________________。
(4)若环状酯E与NaOH水溶液共热,则发生反应的化学方程式为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机化合物的结构简式为 ,下列有关该化合物的叙述不正确的是
,下列有关该化合物的叙述不正确的是
A.该有机物的分子式为C11H12O2
B.1mol该物质最多能与4molH2发生反应
C.该有机物分子中所有原子一定在同一个平面上
D.该有机物一定条件下,可以发生取代、加成、氧化、酯化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】迄今为止科学家在星云中已发现180多种星际分子,近年来发现的星际分子乙醇醛分子模型如图所示。有关乙醇醛说法不正确的是
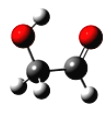
A. 有2种含氧官能团
B. 能发生银镜反应
C. 与乙醛互为同系物
D. 与乙酸互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将15.2 g 铜和镁组成的混合物加入250 mL4.0 mol L-1的稀硝酸中,固体完全溶解,生成的气体只有NO。向所得溶液中加入1.0 L NaOH溶液,此时金属离子恰好沉淀完全,沉淀质量为25.4 g,下列说法不正确的是
A. 原固体混合物中,Cu和Mg的物质的量之比为2:1
B. 氢氧化钠溶液的浓度为0.8 mol·L-1
C. 固体溶解后的溶液中硝酸的物质的量为0.1mol
D. 生成的NO气体在标况下的体积为4.48L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由丙烯经下列反应制得F、G两种高分子化合物,它们都是常用的塑料。

(1)F的结构简式为________。
(2)在一定条件下,两分子E能脱去两分子形成一种六元环状化合物,该化合物的结构简式为_______。
(3)①B→C 化学方程式为______。
②C与含有NaOH的Cu(OH)2悬浊液反应的化学方程式为______。
③E→G化学方程式为______。
(4)手性分子X为E的一种同分异构体,lmolX与足量金属钠反应产生lmol氢气,lmolX与足量银氨溶液反应能生成2molAg,则X的结构简式为_______。
(5)用G代替F制成一次性塑料餐盒的优点是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸盐具有极强的氧化性,可作水处理剂。低温下,在Na2FeO4溶液中加入KOH浓溶液可析出K2FeO4。完成下列填空:
(1)写出上述得到K2FeO4的化学方程式_____。
(2)Na2FeO4和稀H2SO4发生如下反应:Na2FeO4+H2SO4→Fe2(SO4)3+O2↑+Na2SO4+H2O。配平上述化学方程式_____。若反应中产生3.36L(标准状况)的氧气,则转移电子数为_____。
(3)实验室配制Fe2(SO4)3溶液时,需加入少量稀硫酸,结合离子方程式用化学平衡移动原理解释其原因______。
(4)在Fe2(SO4)3溶液中滴加NaHSO3溶液,n(SO42-)增大,则还原产物是____。写出检验上述反应中Fe2(SO4)3是否消耗完全的方法______。
(5)已知HSO3-在水中既能水解也能电离。NaHSO3溶液呈酸性,溶液中c(H2SO3)_____c(SO32-)(选填“>”、“<”或“=”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com