
| 10-14 |
| 0.01 |


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/10-4mol?L-1 | 10.0 | 4.05 | 2.50 | 1.60 | 1.00 | 1.00 |
| c(CO)/10-3mol?L-1 | 3.60 | 3.05 | 2.85 | 2.76 | 2.70 | 2.70 |
| A、2~3s间的平均反应速率v(NO)=9×10-5mol/(L?s) |
| B、催化转化器对废气的转化速率在夏季时比冬季时高 |
| C、若该催化转化器气舱容积为2L,则达到平衡时反应放出热量1.8a J |
| D、该温度下,此反应的平衡常数K=5000 |
查看答案和解析>>
科目:高中化学 来源: 题型:
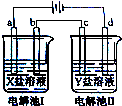 如图所示的电解池I和II中,a、b、c和d均为Pt电极.电解过程中,电极b和d上没有气体逸出,但质量均增大,且增重b>d.符合上述实验结果的盐溶液是( )
如图所示的电解池I和II中,a、b、c和d均为Pt电极.电解过程中,电极b和d上没有气体逸出,但质量均增大,且增重b>d.符合上述实验结果的盐溶液是( )| 选项 | X | Y |
| A. | MgSO4 | CuSO4 |
| B. | AgNO3 | CuSO4 |
| C. | FeSO4 | Al2(SO4)3 |
| D. | CuSO4 | AgNO3 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
| A | B | C | |||
| 1 | 35 | 2 | 4 | 1.6 | 5 |
| 2 | 60 | 1 | 2 | 0.4 | 3 |
| 3 | 60 | 1 | 2 | 0.4 | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、反应放出热量x=0.05a |
| B、反应达到平衡状态时,2v(SO2)消耗=v(O2)生成 |
| C、若恒温恒压下,在10L的密闭容器中加入0.1mol SO2和0.05mol O2,平衡后反应放出的热量y kJ,则y<x |
| D、升高温度,平衡常数变小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.6mol |
| B、1mol |
| C、0.8mol |
| D、1.2mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
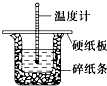 50mL 0.50mol?L-1盐酸与50mL 0.55mol?L-1 NaOH溶液在图示的装置中进行中和反应.通过测定反应过程中的热量可计算中和热.回答下列问题:
50mL 0.50mol?L-1盐酸与50mL 0.55mol?L-1 NaOH溶液在图示的装置中进行中和反应.通过测定反应过程中的热量可计算中和热.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度/℃ | 800 | 1000 | 1200 | 1400 |
| 平衡常数 | 0.45 | 1.92 | 276.5 | 1771.5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com