
【题目】环境监察局常用“定电位NOx传感器来监测化工厂的氮氧化物气体是否达到排放标准,其工作原理如图所示。下列说法不正确的是( )

A.“对电极”是负极
B.“工作电极”上发生的电极反应为NO2+2e-+2H+=NO+H2O
C.传感器工作时H+移向“对电极”
D.“对电极”的材料可能为活泼金属锌
 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.标准状况下,1.12LCl2溶于2L水,溶液中含氯粒子的数目等于0.1NA
B.含有C-Si键数目为2NA的SiC晶体中硅原子的物质的量为1mol
C.14.0gFe发生吸氧腐蚀最终生成Fe2O3·xH2O,电极反应转移的电子数为0.5NA
D.室温下,0.05mol/L的硝酸铵溶液中氮原子数目为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究一溴环己烷(![]() )与NaOH 的醇溶液共热发生的是水解反应还是消去反应,甲、乙、丙三位同学分别设计了如下三种实验方案。
)与NaOH 的醇溶液共热发生的是水解反应还是消去反应,甲、乙、丙三位同学分别设计了如下三种实验方案。
甲:向反应混合液中滴入稀硝酸中和NaOH 溶液,然后滴入AgNO3溶液,若有淡黄色沉淀生成,则可证明发生了消去反应。
乙:向反应混合液中滴入溴水,若溶液颜色很快褪去,则可证明发生了消去反应。
丙:向反应混合液中滴入酸性FeCl3溶液,若溶液颜色变为紫色,则可证明发生了水解反应。
其中正确的是( )
A.甲B.乙
C.丙D.上述实验方案都不正确
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在20mL0.1mol·L-1 HCl溶液中加入同体积、同物质的量浓度的NH3·H2O溶液,反应后溶液中各粒子浓度的关系错误的是
A.c(H+)+c(![]() )=c(OH-)+c(Cl-)B.c(H+)+c(Cl-)=c(OH-)+c(NH3·H2O)
)=c(OH-)+c(Cl-)B.c(H+)+c(Cl-)=c(OH-)+c(NH3·H2O)
C.c(Cl-)>c(![]() )>c(H+)>c(OH-)D.c(Cl-)=c(
)>c(H+)>c(OH-)D.c(Cl-)=c(![]() )+c(NH3·H2O)
)+c(NH3·H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积固定的密闭容器中发生反应:![]() 。下列叙述中不能说明上述反应已达到化学平衡状态的是
。下列叙述中不能说明上述反应已达到化学平衡状态的是
A.混合气体的密度不变
B.体系的压强不变
C.混合气体的平均相对分子质量不变
D.反应体系中乙醇的物质的量浓度不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学电源在日常生活和高科技领域中都有广泛应用。下列说法不正确的是
A.  Zn2+向Cu电极方向移动,Cu电极附近溶液中H+浓度增加
Zn2+向Cu电极方向移动,Cu电极附近溶液中H+浓度增加
B.  正极的电极反应式为Ag2O+2e+H2O2Ag+2OH
正极的电极反应式为Ag2O+2e+H2O2Ag+2OH
C.  锌筒作负极,发生氧化反应,锌筒会变薄
锌筒作负极,发生氧化反应,锌筒会变薄
D.  使用一段时间后,电解质溶液的酸性减弱,导电能力下降
使用一段时间后,电解质溶液的酸性减弱,导电能力下降
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】298K时,将20mL3xmol·L-1Na3AsO3、20mL3xmol·L-1I2和20mLNaOH溶液混合,发生反应:AsO33-(aq)+I2(aq)+2OH-(aq)![]() AsO43-(aq)+2I-(aq)+H2O(l)。溶液中c(AsO43-)与反应时间(t)的关系如图所示。
AsO43-(aq)+2I-(aq)+H2O(l)。溶液中c(AsO43-)与反应时间(t)的关系如图所示。
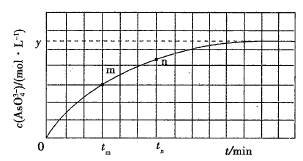
下列可判断反应达到平衡的是__(填标号)
a溶液的pH不再变化
b.v(I-)=2v(AsO33-)
c.![]() 不再变化
不再变化
d.c(I-)=ymol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学实验在学科中有着非常重要的作用,结合图示实验装置,下列相关分析的描述不正确的是( )
A.图1:盐桥中使用KCl溶液,电子的流向是Zn→G→Cu→CuSO4溶液→盐桥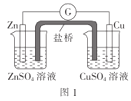
B.图2:可根据该实验验证铁的吸氧腐蚀
C.图3:在强酸和强碱的中和热实验中,强碱的浓度比强酸的略大
D.图4:根据两烧瓶中气体颜色的变化(热水中变深、冰水中变浅)可以判断反应2NO2(g)![]() N2O4(g)是一个放热反应
N2O4(g)是一个放热反应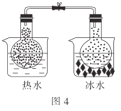
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在0.4 L由NaCl、MgCl2、CaCl2组成的混合液中,部分离子浓度大小如图所示,回答下列问题。
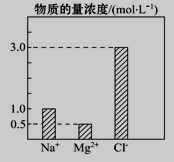
(1)该混合液中,NaCl的物质的量为________mol,含溶质MgCl2的质量为________g。
(2)该混合液中CaCl2的物质的量为_________mol,将该混合液加水稀释至体积为1L,稀释后溶液中Ca2+的物质的量浓度为___________mol·L-1。
(3)向该稀释后的溶液中加入足量硝酸酸化的硝酸银溶液,可得到沉淀__________mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com