
| A.酸性强弱:HI04>HBr04>HCl04 |
| B.原子半径大小:Mg>P>N |
| C.碱性强弱:KOH>NaOH>LiOH |
| D.金属性强弱:Na>Mg>Al |
科目:高中化学 来源:不详 题型:单选题
| A.Y、Z的气态氢化物,前者更稳定 |
| B.Z、W的最高价氧化物对应水化物的酸性,前者强 |
| C.X、W的气态氢化物相互反应,生成物中既含离子键又含共价键 |
| D.Y、W的单质,均可通过电解的方法获得 |

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Na是第三周期中金属性最强的元素 |
| B.Cl是第三周期中非金属性最强的元素 |
| C.A1的氧化物属于两性氧化物 |
| D.Si的最高氧化物的水化物属于强酸 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A | B | |
| C | D |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.第15列元素的最高价氧化物为R2O5 |
| B.第2列元素中肯定没有非金属元素 |
| C.L层电子数为偶数的所有主族元素所在族的族序数与元素原子L层电子数相等 |
| D.M层电子数为奇数的所有主族元素所在族的族序数与元素原子M层电子数相等 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.ⅠA族元素的金属性一定比ⅡA族元素的金属性强 |
| B.族序数等于其周期序数的元素一定是金属元素 |
| C.全部由非金属元素组成的化合物中只含共价键 |
| D.13C和14C互为同位素,化学性质相似 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
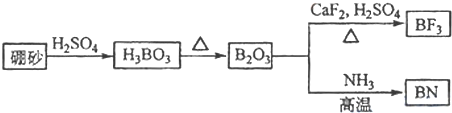
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题


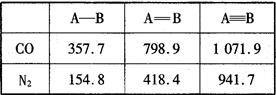
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com