
科目:高中化学 来源: 题型:解答题
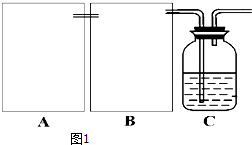
查看答案和解析>>
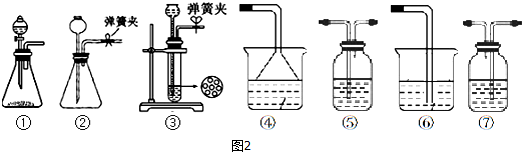
科目:高中化学 来源: 题型:解答题
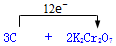 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 干冰、液态氯化氢都是电解质 | |
| B. | 根据是否具有丁达尔效应,将分散系分为溶液、浊液和胶体 | |
| C. | NaOH晶体中既含有离子键又含有共价键 | |
| D. | Na2O、Fe2O3、Al2O3既属于碱性氧化物,又属于离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
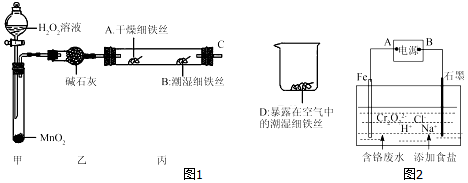
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高纯度的硅单质广泛用于制作光导纤维,光导纤维遇强碱会“断路” | |
| B. | 我国油品从国IV汽油升级到国V汽油,有助于减少酸雨、雾霾,提高空气质量 | |
| C. | 臭氧是氧化性极强的淡蓝色气体,可用作自来水的消毒剂 | |
| D. | 科学家发现一种新细菌的DNA链中有砷(As)元素,该As元素最有可能取代普通DNA链中的P元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
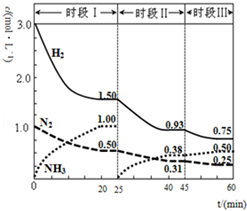 N2(g)+3H2(g)?2NH3(g);△H=-94.4kJ•mol-1.恒容时,体系中各物质浓度随时间变化的曲线如图.
N2(g)+3H2(g)?2NH3(g);△H=-94.4kJ•mol-1.恒容时,体系中各物质浓度随时间变化的曲线如图.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com