
| A、该溶液中一定含有NO3-、SO42-、NH4+ |
| B、根据实验④可推出溶液中不存在NO2-与SO32- |
| C、往一定量该溶液中加入足量Ba(NO3)2溶液,静置后往上层清液中滴加硝酸酸化的AgNO3溶液,若有白色沉淀生成,说明溶液中含有Cl- |
| D、根据实验①可推出溶液中含有NO3-或NO2- |


科目:高中化学 来源: 题型:
| A | B | C | D | E | F | G | |
| A | - | - | - | - | - | - | ↓ |
| B | - | - | - | - | ↓ | ↓ | ↓ |
| C | - | - | - | ↓ | - | ↓ | ↓ |
| D | - | - | ↓ | - | ↓ | ↓ | ↓ |
| E | - | ↓ | - | ↓ | - | ↓ | - |
| F | - | ↓ | ↓ | ↓ | ↓ | - | ↓ |
| G | ↓ | ↓ | ↓ | ↓ | - | ↓ | - |
查看答案和解析>>
科目:高中化学 来源: 题型:
 | 0.1 | 0.5 | 1 | 10 |
| 400 | 99.2 | 99.6 | 99.7 | 99.9 |
| 500 | 93.5 | 96.9 | 97.8 | 99.3 |
| 600 | 73.7 | 85.8 | 89.5 | 96.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验序号 | 实验内容 | 实验结果 |
| ① | 加AgNO3溶液 | 有白色沉淀生成 |
| ② | 加足量NaOH溶液并加热 | 收集到气体1.12L(已折算成标准状况下的体积) |
| ③ | 加足量BaCl2溶液时,所得沉淀为6.27g,向沉淀中加足量稀盐酸,然后干燥、称量为2.33g. | |
| 阴离子符号 | 物质的量浓度(mol?L-1) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 阳离子 | Ag+、Mg2+、Al3+、Ba2+ |
| 阴离子 | Cl-、SO42-、NO3-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、所配制的NaOH溶液物质的量浓度为1.0 mol/L |
| B、操作2是将NaOH加水溶解后直接转移到容量瓶中 |
| C、操作4是滴加水至溶液凹液面的最低点与刻度线平齐 |
| D、操作5中,定容摇匀后发现液面低于刻度线,不能再继续加水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 氨气是一种重要的物质,可用于制取化肥和硝酸等.已知H-H键、N-H键、N≡N键的键能分别是436kJ/mol、391kJ/mol、946kJ/mol.
氨气是一种重要的物质,可用于制取化肥和硝酸等.已知H-H键、N-H键、N≡N键的键能分别是436kJ/mol、391kJ/mol、946kJ/mol.查看答案和解析>>
科目:高中化学 来源: 题型:
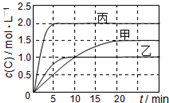 向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:xA(g)+B(g)?2C(g).各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别用下表和如图表示:下列说法正确的是( )
向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:xA(g)+B(g)?2C(g).各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别用下表和如图表示:下列说法正确的是( )| 容器 | 甲 | 乙 | 丙 |
| 容积 | 0.5L | 0.5L | 1.0L |
| 温度 | T1 | T2 | T2 |
| 反应物 起始量 | 0.5molA 1.5molB | 0.5molA 1.5molB | 2.0molA 6.0molB |
| A、由图可知:T1<T2,且该反应为吸热反应 |
| B、T2时该反应的平衡常数K=0.8 |
| C、前10min乙、丙两容器中v(A)乙>v(A)丙 |
| D、C的质量m:m甲=m乙<2m丙 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com