


| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
| ��ѧʽ | CO(g) | H2(g) | CH3OH(l) | CH4(g) |
| ��H/(kJ/mol) | -283.0 | -285.8 | -726.5 | -890.3 |
| A��1��1 | B��1��3 | C��1��4 | D��2��3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
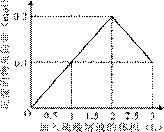
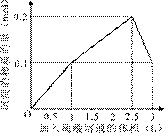
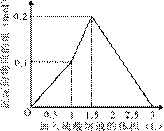
 ���ܱ�ʾ��Ӧ�������������ʵ��������������Һ���֮���ϵ����
���ܱ�ʾ��Ӧ�������������ʵ��������������Һ���֮���ϵ����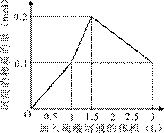
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A�������£�ͬŨ�ȵ�һԪ��HA��HB���룬����ͬŨ�ȵ�NaA��Һ��NaB��Һ��pH�� |
| B��0��2mol/L NH4NO3��0��1 mol/L NaOH��Һ�������Ϻ� c��NH��>c��NO��>c��Na����>c��OH����>c��H���� |
| C�����ʵ���Ũ����ȵĴ�����Һ������������Һ�������ϣ� c��Na������c��H������c��CH3COO������c��OH������c��CH3COOH�� |
| D��ͬŨ�ȵ�������Һ����NH4Al��SO4��2����NH4Cl����NH3��H2O����CH3COONH4������c��NH���ɴ�С��˳���ǣ���>��>��>�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��100 | B��1/100 | C��3 | D��1/3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A���٢ܢ� | B���٢ݢ� | C���٢ڢ� | D���٢ڢۢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��1 mol SO2��g���������ܺʹ���l mol S��s����1 mol O2��g���������ܺ� |
| B��1���������1���������ӷ�Ӧ����2����������������ӷų�297.23 kJ���� |
| C��S��g��+O2��g����SO2��g��+QkJ�� Q1��ֵ����297.23 |
D��S��g��+O2��g����SO2��g��+QkJ��Q1��ֵС��297.2 3 3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A����������ǿ�ᡢǿ�������кͺ�pH��7�����к�֮ǰpH����pH����14 |
| B��Ϊ�����к͵ζ����ߣ��ڵζ������У�ÿ����ͬʱ����pH�Ʋⶨһ����ƿ����Һ��pH |
| C���ⶨ��Һ��pHʱ��Ӧ�Ƚ�pH��ֽ��ʪ��Ȼ����м�� |
| D����pH��12����Һ�У�ˮ�������c(OH��)��10��2mol��L��1 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com