
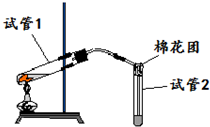
 如图是实验室用铜片与浓硫酸反应制取SO2,并验证其性质的装置图.往试管1中加入一小块铜片,再加入3~5mL浓硫酸,用带导管的单孔橡胶塞塞好试管,加热,将生成的气体通入试管2的溶液中.回答以下问题:
如图是实验室用铜片与浓硫酸反应制取SO2,并验证其性质的装置图.往试管1中加入一小块铜片,再加入3~5mL浓硫酸,用带导管的单孔橡胶塞塞好试管,加热,将生成的气体通入试管2的溶液中.回答以下问题:分析 铜和浓硫酸在加热条件下能发生生成硫酸铜和二氧化硫、水,发生Cu+2H2SO4(浓) $\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,生成的二氧化硫具有还原性,可与酸性高锰酸钾发生氧化还原反应,二氧化硫可与氢氧化钠溶液反应而被吸收,防止污染空气,以此解答该题.
解答 解:(1)浓硫酸与铜在加热条件下生成反应CuSO4、SO2和H2O,反应的化学方程式为Cu+2H2SO4(浓) $\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,
故答案为:Cu+2H2SO4(浓) $\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
(2)若试管2中的溶液是KMnO4溶液,反应一段时间后,二者发生氧化还原反应,高锰酸钾溶液褪色,证明二氧化硫具有还原性,故答案为:还原;
(3)二氧化硫有毒,所以不能直接排空,二氧化硫是酸性氧化物,能和碱反应生成盐和水,所以试管2的管口塞一团浸有NaOH溶液的棉花的作用是吸收未反应的SO2气体,离子方程式为:SO2+2OH-=SO32-+H2O,
故答案为:吸收未反应的SO2气体(或SO2尾气处理,避免环境污染);
(4)试管1中含有浓硫酸,稀释时为防止酸液飞溅,可将试管沿烧杯内壁缓缓倒入烧杯中,并用玻璃棒不断搅拌,故答案为:将试管沿烧杯内壁缓缓倒入烧杯中,并用玻璃棒不断搅拌.
点评 本题考查了浓硫酸的化学性质、二氧化硫的性质及检验方法,为高频考点,侧重于学生的分析能力和实验能力的考查,题目难度中等,注意掌握浓硫酸的化学性质,明确二氧化硫的漂白性是暂时的,加热时会恢复原来的颜色.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
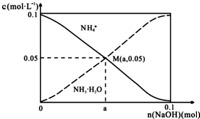 常温下,向1L0.1mol•L-1NH4Cl溶液中,不断加入固体NaOH后,NH4+与NH3•H2O的变化趋势如图所示(不考虑体积变化和氨的挥发),下列说法正确的是( )
常温下,向1L0.1mol•L-1NH4Cl溶液中,不断加入固体NaOH后,NH4+与NH3•H2O的变化趋势如图所示(不考虑体积变化和氨的挥发),下列说法正确的是( )| A. | M点溶液中水的电离程度比原溶液大 | |
| B. | 在M点时,n(OH-)-n(H+)=(a-0.05)mol | |
| C. | 随着NaOH的加入,$\frac{c({H}^{+})}{c(N{H}_{4}^{+})}$不断增大 | |
| D. | 当n(NaOH)=0.05mol时溶液中有:c(Cl-)>c(Na+)>c(NH4+)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中Ca2+数目不变 | B. | 溶液中c(Ca2+)增大 | ||
| C. | 溶液pH值增大 | D. | 溶液pH值不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
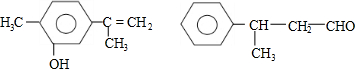
| A. | 可用红外光谱区分,但不能用核磁共振氢谱区分 | |
| B. | 分子中最多都有10个碳原子共平面 | |
| C. | 不是同分异构体 | |
| D. | 均能与溴水反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 容器编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
| CH3OH | CH3OCH3 | H2O | ||
| Ⅰ | 387 | 0.20 | 0.080 | 0.080 |
| Ⅱ | 207 | 0.20 | 0.090 | 0.090 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
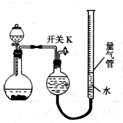 某同学设计如图所示装置分别进行探究实验(夹持装置已略去),请回答下列问题:
某同学设计如图所示装置分别进行探究实验(夹持装置已略去),请回答下列问题:| 实验 | 药品 | 制取气体 | 量气管中液体 |
| Ⅰ | Cu、稀HNO3 | NO | H2O |
| Ⅱ | NaOH(s)、浓氨水 | NH3 | |
| Ⅲ | 过氧化钠、水 | O2 | H2O |
| Ⅳ | 镁铝合金、NaOH溶液 | H2 | H2O |

| 编号 | 镁铝合金 | 量气管第一次读数 | 量气管第二次读数 |
| ① | 1.0g | 10.0mL | 346.3mL |
| ② | 1.0g | 10.0mL | 335.0mL |
| ③ | 1.0g | 10.0mL | 345.7mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
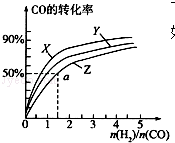 甲醇是重要的燃料,有广阔的应用前景:工业上一般以CO和为原料合成甲醇,该反应的热化学方程式为:CO(g)+2H2(g)═CH3OH(g)△H1=-116kJ•mol-1
甲醇是重要的燃料,有广阔的应用前景:工业上一般以CO和为原料合成甲醇,该反应的热化学方程式为:CO(g)+2H2(g)═CH3OH(g)△H1=-116kJ•mol-1查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com