
| A、生成40.0LN2(标准状况) |
| B、有0.250molKNO3被氧化 |
| C、转移电子的物质的量为1.25mol |
| D、被氧化的N原子的物质的量为3.5mol |
| 1 |
| 3 |
| 1.75mol |
| 14mol |
| 1 |
| 3 |
| 1.75mol |
| 14mol |
| 1.75mol |
| 14mol |
| 1.75mol |
| 14mol |


 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案科目:高中化学 来源: 题型:
| 化学键 | P-P | P-O | OO | PO |
| 键能(kJ?mol-1) | 198 | 360 | 498 | X |

查看答案和解析>>
科目:高中化学 来源: 题型:
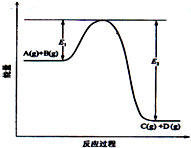 反应A(g)+B(g) 错误!未找到引用源C(g)+D(g)过程中的能量变化如图所示,请回答下列问题:
反应A(g)+B(g) 错误!未找到引用源C(g)+D(g)过程中的能量变化如图所示,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| ||
| 高温 |
| 气体 | SO2 | O2 | SO3 |
| 物质的量(mol) | 1.6 | 1.8 | 0.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 将一定量的Mg、Al投入100mL一定的物质的量浓度的盐酸中,合金全部溶解.向所得溶液中滴加5mol/L的NaOH至过量,生成的沉淀的质量与加入NaOH的体积的关系如图所示.
将一定量的Mg、Al投入100mL一定的物质的量浓度的盐酸中,合金全部溶解.向所得溶液中滴加5mol/L的NaOH至过量,生成的沉淀的质量与加入NaOH的体积的关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、④③②① | B、①④③② |
| C、②③④① | D、①④②③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com