
| A. | 与乙酸互为同分异构体 | B. | 属于高分子化合物 | ||
| C. | 不能发生氧化反应 | D. | 可用作燃料 |
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:解答题
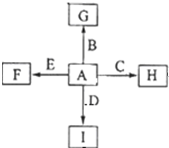 如图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物,已知:
如图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物,已知:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2FeO4在净水过程中能转变成氢氧化铁 | |
| B. | Na2FeO4能杀菌消毒 | |
| C. | Na2FeO4能除去水中的硫化氢等还原性气体杂质 | |
| D. | Na2FeO4能吸附水中的颜色和固体颗粒 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
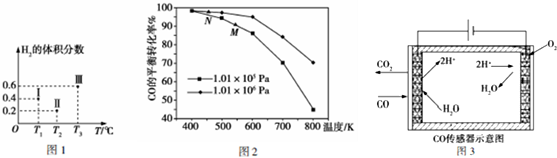
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 减少化石能源的使用,大力发展太阳能、风能等新能源 | |
| B. | 淘汰落后产能,将污染严重的企业从城市迁往农村 | |
| C. | 控制城市机动车持有量,实行机动车限号行驶 | |
| D. | 倡导绿色化学理念,努力实现“原子经济” |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
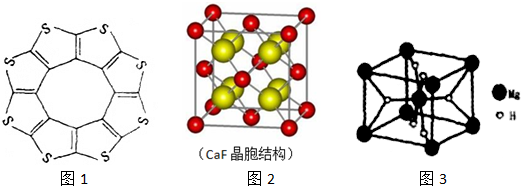
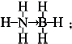 ;与氨硼烷互为等电子体的有机小分子是CH3CH3(写结构简式).
;与氨硼烷互为等电子体的有机小分子是CH3CH3(写结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
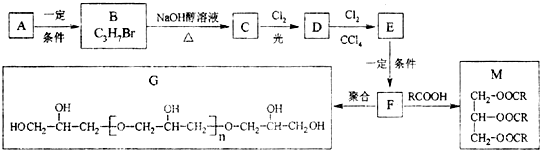
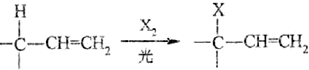
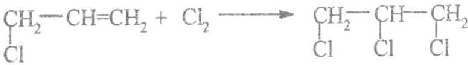 .
.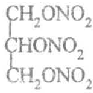 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 | |
| B. | 由单质A转化为单质B△H=+119kJ/mol,可知单质B比单质A稳定 | |
| C. | 稀溶液中:H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ/mol | |
| D. | 在25℃、101kPa时,2g H2完全燃烧生成液态水,放出285.8kJ热量,则表示H2燃烧热的化学方程式为2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com