
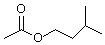
 ��������۷���Ϣ�صijɷ�֮һ�������㽶����ζ��ʵ�����Ʊ������������ķ�Ӧװ��ʾ��ͼ���йصļ��Ⱥͼг�������ȥ�����й��������£�
��������۷���Ϣ�صijɷ�֮һ�������㽶����ζ��ʵ�����Ʊ������������ķ�Ӧװ��ʾ��ͼ���йصļ��Ⱥͼг�������ȥ�����й��������£�| ��Է������� | �ܶ�/��g•cm-3�� | �е�/�� | ˮ���ܽ��� | |
| ���촼 | 88 | 0.8123 | 131 | �� |
| ���� | 60 | 1.0492 | 118 | �� |
| ���������� | 130 | 0.8670 | 142 | ���� |
���� ��װ��A�м��뷴Ӧ������2��3Ƭ���Ƭ����ʼ��������A��������������������50���ӣ���ӦҺ�������º����Һ©���У���������ˮϴ��������ʹ��ᣬ����ˮϴ��̼��������Һ���ֳ��IJ������������ˮ����þ�����������������Ƭ�̣����˳�ȥ����þ���壬�����������ռ�140��143����֣���������������
��1��CH3COOH�루CH3��2CHCH2CH2OH��Ӧ����CH3COOCH2CH2CH��CH3��2��H2O��
��2��������λ����ƿ�Ϸ�������������������ԭ�ϳ�����ã������Һ����Ϊ��ֹ������Ҫ�������Ƭ��
��3�����������������е��ϻ�ѧƽ���ƶ�Ӱ�����ؽ��
��4�������������������ܶȼ���ȷ�ķ�Һ�����������н��
��5��������ˮ����þ�ܹ�����������������������ˮ�֣��������ã�
��6���ȼ������������촼�����ʵ�����Ȼ���жϹ�����������ݲ�����������������������������������ʵ�����������ʵ������ȡ��������������������ʣ�
��� �⣺��1��CH3COOH�루CH3��2CHCH2CH2OH��Ӧ����CH3COOCH2CH2CH��CH3��2��H2O����ѧ����ʽΪCH3COOH+��CH3��2CHCH2CH2O$?_{��}^{Ũ����}$CH3COOCH2CH2CH��CH3��2+H2O��
�ʴ�Ϊ��CH3COOH+��CH3��2CHCH2CH2O$?_{��}^{Ũ����}$CH3COOCH2CH2CH��CH3��2+H2O��
��2�����������ܵ������� ����������ʹ��Ӧ�������ã������Һ����Ϊ��ֹ������Ҫ�������Ƭ��
�ʴ�Ϊ�����������������У�
��3��A��ԭ��û�г�ַ�Ӧ��ƫ�ͣ�
B�������˸���Ӧ��ƫ�ͣ�
C���ڽ�����������ʱ����143�濪ʼ�ռ���֣�ƫ�ͣ�
�ʴ�Ϊ��A��B��C��
��4�����������ܶȱ�ˮС�����������ܣ����ˮ���²㣬�����ϲ㣻��Һʱ��Ҫ�Ƚ�ˮ��ӷ�Һ©�����¿ڷų�����������Һ�����ʱ�رշ�Һ©���Ļ������ٽ��������������Ͽڷų���������ȷ��ΪD��
�ʴ�Ϊ��D��
��5��ʵ���м���������ˮ����þ��Ŀ������������������ˮ�֣�������и��
�ʴ�Ϊ������������������
��6����������ʵ���Ϊ��n=$\frac{6.0g}{60g/mol}$=0.1mol�����촼�����ʵ���Ϊ��n=$\frac{4.4g}{88g/mol}$=0.05mol��������������촼�ǰ���1��1���з�Ӧ���������������������������������Ҫ�������촼�����ʵ������㣬������������0.05mol������������ʵ�������ɵ����������������ʵ���Ϊ=$\frac{2.6g}{130g/mol}$=0.02mol������ʵ���������������IJ���Ϊ��$\frac{0.02mol}{0.05mol}$��100%=40%��
�ʴ�Ϊ��B��
���� ���⿼���˳��������Ĺ����밲װ�������ķ��롢�ᴿ�����ʵ���ȡ��ҩƷ��ѡ��ʹ�á����ʲ��ʵļ����֪ʶ����Ŀ�Ѷ��еȣ������漰�������ϴ�֪ʶ��϶࣬���������ѧ���ķ������������������Ӧ����ѧ֪ʶ��������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
�鿴�𰸺ͽ���>>
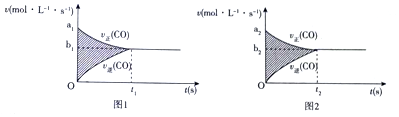
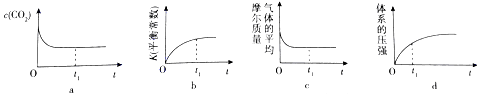
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�����ʡ�߶���10���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
0.1mol/L NH4Cl��Һ�У���������������� �� ��
A��c(NH4+)��c(Cl��)��c(OH��)��c(H+)
B��c(Cl��)��c(NH4+)��c(H+)��c(OH��)
C��c(NH4+)+c(H+)=c(Cl��)+c(OH��)
D��c(NH4+)+c(NH3 ��H2O)=c(Cl��)
��H2O)=c(Cl��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

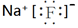 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
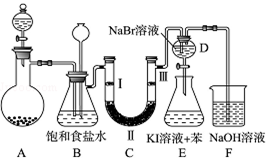
 ʵ���Һϳ����������磨��ͼ��ʾ�����õ������Ҵ��������ˮ�����������ֲ�Ʒ����ش��������⣺����֪���Ҵ������ᡢ���������ķе������ǣ�78.5�桢118�桢77.1�棩
ʵ���Һϳ����������磨��ͼ��ʾ�����õ������Ҵ��������ˮ�����������ֲ�Ʒ����ش��������⣺����֪���Ҵ������ᡢ���������ķе������ǣ�78.5�桢118�桢77.1�棩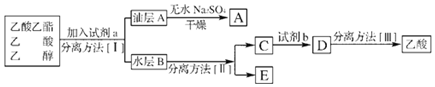
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�����ʡ�߶���10���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
���л���������������ʵ���( )
A��HCl B��Ba(OH)2 C��CO2 D��NH3��H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com