
| A. | 漂白粉的有效成分是氯酸钙 | |
| B. | 将过量铁粉加入稀硝酸中,有气体生成,充分反应后滴加KSCN溶液,溶液呈血红色 | |
| C. | 将铜粉加1.0mol•L-1Fe2(SO4)3溶液中,溶液变蓝、有黑色固体出现 | |
| D. | 二氧化硅是制造光导纤维的材料 |
分析 A、漂白粉的有效成分是次氯酸钙;
B、过量铁粉与稀硝酸反应生成亚铁离子;
C、Cu和Fe3+发生氧化还原反应生成Fe2+和Cu2+;
D、光导纤维的材料的成份是二氧化硅.
解答 解:A、漂白粉的有效成分是次氯酸钙,而不是氯酸钙,故A错误;
B、过量铁粉与稀硝酸反应生成亚铁离子,而亚铁离子与KSCN溶液,不显色,故B错误;
C、Cu和Fe3+发生氧化还原反应,反应方程式为Cu+2Fe3+=Cu2++2Fe2+,所以没有黑色沉淀生成,溶液由黄色变为蓝色,故C错误;
D、光导纤维的材料的成份是二氧化硅,所以二氧化硅是制造光导纤维的材料,故D正确;
故选D.
点评 本题考查元素化合物的知识,为高频考点,涉及漂白粉的有效成分、铝及其氧化物的性质、氧化还原反应、硝酸的性质等知识点,侧重考查基本理论、元素化合物性质,注意把握实验原理及操作方法,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 氟氯烃的肆意排放会加速臭氧层的破坏,使大气层中的紫外线增强 | |
| B. | 不慎将苯酚沾到皮肤上应立即用酒精清洗 | |
| C. | 淀粉、蛋白质、油脂均是天然高分子化合物 | |
| D. | 除去乙酸乙酯中少量的乙酸:用饱和碳酸钠溶液洗涤后分液、干燥、蒸馏即可 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
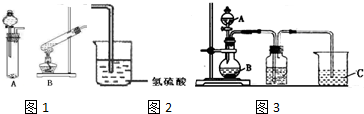

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 易失去电子的物质 | B. | 原子核外有10个电子的微粒 | ||
| C. | 原子的最外层只有1个电子的元素 | D. | 原子核内有13个质子的元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ⑥⑧ | C. | ②⑤ | D. | ③④⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
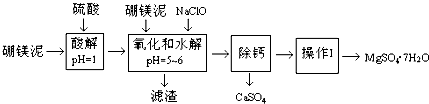
| 温度(℃) | 40 | 50 | 60 | 70 |
| MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
| CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com