
某元素+3价离子的电子排布式为1s22s22p63s23p63d5,则该元素在周期表中的位置为( )
A.VB族 B.ⅢB族 C.Ⅷ族 D.ⅤA族
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
下列有关离子组的评价及相关离子方程式均正确的是( )
| 选项 | 离子组 | 评价及离子方程式 |
| A | H+、Fe2+、NO | 不能大量共存于同一溶液中,因为发生反应:Fe2++2H+===Fe3++H2↑ |
| B | Na+、K+、HCO | 不能大量共存于同一溶液中,因为发生反应:HCO |
| C | Ca2+、NH | 能大量共存于同一溶液中 |
| D | Na+、NH | 能大量共存于同一溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
离子反应是中学化学中重要的反应类型。回答下列问题:
(1)在发生离子反应的反应物或生成物中,一定存在______(填序号)。
①单质 ②氧化物 ③电解质 ④盐 ⑤化合物
(2)可用图示的方法表示不同反应类型之间的关系。如分解反应和氧化还原反应可表示为下图。请在下面的方框中画出离子反应、置换反应和氧化还原反应三者之间的关系。
(3)离子方程式是重要的化学用语。下列是有关离子方程式的一些错误观点,请在下列表格中用相应的“离子方程式”否定这些观点。
| ①所有的离子方程式均可以表示一类反应 | |
| ②酸碱中和反应均可表示为H++OH-===H2O | |
| ③离子方程式中凡是难溶性酸、碱、盐均要标“↓”符号 |
(4)试列举出三种不同类别的物质(酸、碱、盐)之间的反应,它们对应的离子方程式都可用“Ba2++SO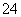 ===BaSO4↓” 来表示,请写出有关反应的化学方程式(3个):
===BaSO4↓” 来表示,请写出有关反应的化学方程式(3个):
①________________________________________________________________________;
②________________________________________________________________________;
③________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列现象与氢键有关的是( )
①NH3的熔、沸点比ⅤA族其他元素氢化物的高 ②小分子的醇、羧酸可以和水以任意比互溶 ③冰的密度比液态水的密度小 ④尿素的熔、沸点比醋酸的高 ⑤邻羟基苯甲酸的熔、沸点比对羟基苯甲酸的低 ⑥水分子高温下很稳定
A.①②③④⑤⑥ B.①②③④⑤
C.①②③④ D.①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D为原子序数小于18的四种元素:
①A原子的电子层数等于最外层电子数;
②A与B处于同一周期,B与D可形成离子化合物D2B,该化合物的水溶液显碱性;
③C的离子核内质子数与核外电子数之和为18;
④A、C、D三种元素的离子具有相同的电子层排布。推断A~D各为何种元素,并填空:
(1)A________;B________;C________;D________。
(2)各原子形成简单离子的电子排布式。
(3)四种元素离子半径的大小顺序为______________________________。
(4)用离子方程式表示D2B水溶液呈碱性的原因:___________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
根据信息回答下列问题:
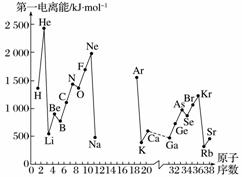
A.第一电离能I1是指气态原子X(g)处于基态时,失去一个电子成为气态阳离子X+(g)所需的最低能量。下图是部分元素原子的第一电离能I1随原子序数变化的曲线图(其中12号至17号元素的有关数据缺失)。
B.不同元素的原子在分子内吸引电子的能力大小可用数值表示,该数值称为电负性。一般认为:如果两个成键原子间的电负性差值大于1.7,原子之间通常形成离子键;如果两个成键原子间的电负性差值小于1.7,通常形成共价键。下表是某些元素的电负性值:
| 元素符号 | Li | Be | B | C | O | F | Na | Al | Si | P | S | Cl |
| 电负性值 | 1.0 | 1.5 | 2.0 | 2.5 | 3.5 | 4.0 | 0.9 | 1.5 | 1.8 | 2.1 | 2.5 | 3.0 |
(1)认真分析信息A图中同周期元素第一电离能的变化规律,推断第3周期Na~Ar这几种元素中,Al的第一电离能的大小范围为______<Al<______(填元素符号)。
(2)从信息A图中分析可知,同一主族元素原子的第一电离能I1的变化规律是________________。
(3)信息A图中第一电离能最小的元素在周期表中的位置是第________周期第________族。
(4)根据对角线规则,Be、Al元素最高价氧化物对应水化物的性质相似,它们都具有________性,其中Be(OH)2显示这种性质的离子方程式是_________________________。
(5)通过分析电负性值的变化规律,确定Mg元素的电负性值的最小范围________________。
(6)请归纳元素的电负性和金属性、非金属性的关系是________________。
(7)从电负性角度,判断AlCl3是离子化合物还是共价化合物,说出理由并写出判断的方法________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室用4 mol SO2与2 mol O2在一定条件下进行下列反应:2SO2(g)+O2(g)2SO3(g) ΔH=-196.64 kJ·mol-1,当放出314.624 kJ热量时,SO2的转化率为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com