
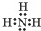 .
.
分析 (1)氮元素原子序数为7,两个电子层最外层5个电子,根据共价化合物电子式的书写规则书写;
(2)将空气中游离态的氮转化为含氮化合物的过程叫氮的固定,如氮气和氢气合成氨、氮气和氧气放电反应生成一氧化氮;
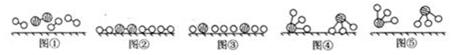
(3)a.氮气分子中是三键;
b.图②是表示N2、H2被吸附在催化剂的表面;图③则表示在催化剂表面,N2、H2中的化学键断裂;
c.在化学变化中,氮分子和氢分子在催化剂的作用下分解成氢原子和氮原子,然后原子又重新组合成新的分子;
(4)依据热化学方程式和盖斯定律计算得到所需热化学方程式;
解答 解:(1)氮元素在周期表中的位置是第二周期,ⅤA族,A氨气是共价化合物,各原子间通过共用电子对形成共价键,所以其电子式为: ,
,
故答案为:第2周期VA族,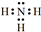 ;
;
(2)将空气中游离态的氮转化为含氮化合物的过程叫氮的固定,如氮气和氢气合成氨、氮气和氧气放电反应生成一氧化氮,反应的化学方程式为:N2+O2$\frac{\underline{\;放电\;}}{\;}$2NO,
故答案为:N2+O2$\frac{\underline{\;放电\;}}{\;}$2NO;
(3)a.图①表示N2、H2分子中不都是单键,氮气是三键,故a错误;
b.分析题中图可以知道,图②表示N2、H2被吸附在催化剂表面,而图③表示在催化剂表面,N2、H2中化学键断裂,图②→图③需要吸收能量,故b正确;
c.在化学变化中,氮分子和氢分子在催化剂的作用下分解成氢原子和氮原子,然后原子又重新组合成新的分子,该过程表示了化学变化中包含旧化学键的断裂和新化学键的生成,故c正确;
故答案为:bc;
(4)①N2(g)+3H2(g)=2NH3(g)△H=-92.4kJ/mol,
②2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ/mol,
依据盖斯定律计算②×3-①×2得到氨气作燃料完全燃烧生成氮气和水蒸气的热化学方程式:4NH3(g)+3O2(g)=2N2(g)+6H2O(g)△H=-1266 kJ/mol,
故答案为:4NH3(g)+3O2(g)=2N2(g)+6H2O(g)△H=-1266 kJ/mol.
点评 本题考查了微粒结构、化学反应实质的理解应用、热化学方程式书写、原电池原理的理解应用,题目难度中等.


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:高中化学 来源: 题型:解答题
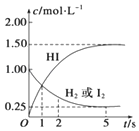 698K时,向某V L的密闭容器中充入3mol H2(g)和3mol I2(g),发生反应:H2(g)+I2(g)?2HI(g),测得各物质的物质的量浓度与时间变化的关系如右图所示.请回答下列问题:
698K时,向某V L的密闭容器中充入3mol H2(g)和3mol I2(g),发生反应:H2(g)+I2(g)?2HI(g),测得各物质的物质的量浓度与时间变化的关系如右图所示.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将2.4g炭完全转化为水煤气,然后再充分燃烧,整个过程放出热量39.35kJ | |
| B. | C的燃烧热为-110.5kJ/mol | |
| C. | H2的燃烧热为-241.8kJ/mol | |
| D. | 由反应③可知,反应过程中转移5mol电子且生成液态水时放出的热量大于604.5kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
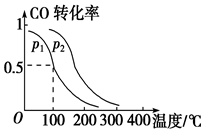 运用化学反应原理研究物质的性质具有重要意义.请回答下列问题:
运用化学反应原理研究物质的性质具有重要意义.请回答下列问题:| Ka1 | Ka2 | |
| H2SO3 | 1.3×10-2 | 6.3×10-8 |
| H2CO3 | 4.2×10-7 | 5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
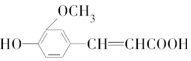 ,符合下列条件的阿魏酸的同分异构体的数目为
,符合下列条件的阿魏酸的同分异构体的数目为| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时正极上的电极反应为:Li-e-═Li+ | |
| B. | 该充电宝的凝胶介质可用KOH水溶液代替 | |
| C. | 充电时每生成14g Li,凝胶介质中有2mol电子通过 | |
| D. | 充电时电池的正极失电子后Li4V2O3会转化为V2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作和现象 | 结 论 |
| A | 向溶液X中滴加BaCl2溶液,有白色沉淀生成 | 溶液X中可能含有SO42- |
| B | 2mL10%的CuSO4溶液中滴加2%的NaOH溶液4~6滴制得新制氢氧化铜,再滴加几滴葡萄糖溶液,加热 | 检验葡萄糖中含有醛基 |
| C | 向1mL浓度均为0.05mol•L-l NaCl、NaI的混合溶液中滴加2滴0.01mol•L-lAgNO3溶液,振荡,沉淀呈黄色 | Ksp (AgCl)<Ksp(AgI) |
| D | 将Al2(SO4)3溶液蒸干、灼烧至恒重 | 最终剩余固体是Al2O3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
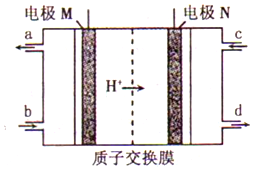 韩国三星公司因为手机电池爆炸而屡屡曝光,电池的安全性和环保性再次被公众所重视. 一种以引火性高的联氨(N2H4)为燃料的环保电池,工作时产生稳定无污染的物质,原理如图所示.下列说法正确的是( )
韩国三星公司因为手机电池爆炸而屡屡曝光,电池的安全性和环保性再次被公众所重视. 一种以引火性高的联氨(N2H4)为燃料的环保电池,工作时产生稳定无污染的物质,原理如图所示.下列说法正确的是( )| A. | N极为电源负极,联氨从c口通入 | |
| B. | 负极上每消耗lmol N2H4,转移6mol电子 | |
| C. | 正极的电极反应式为:O2+2H2O+4e-═4OH- | |
| D. | 可将联氨改进为引火性低、稳定性好的N2H4•H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com