
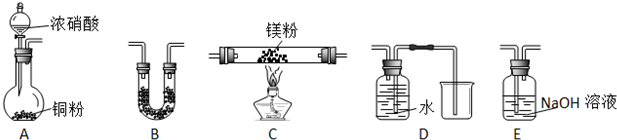
分析 (1)镁和二氧化碳在点燃条件下反应生成MgO和C,同时发出耀眼白光;
(2)①装置A:铜和浓硝酸制取二氧化氮,装置B:干燥二氧化氮,防止水蒸气干扰实验,在加热条件下将Mg和二氧化氮混合,然后再干燥气体,装置C:镁条和二氧化氮反应,装置D:排水法收集N2,装置E:吸收二氧化氮,然后用排水法收集N2;
②氮气不溶于水,如果有氮气,则能通过排水法收集到气体;
(3)①氮化镁和水反应生成氢氧化镁和氨气,氨气能使湿润的红色石蕊试纸变蓝色;
②醋酸铵溶液呈中性,将①中加水后的溶液加热,赶走NH3后,再加入过量的CH3COONH4溶液,根据固体是否溶解分析判断.
解答 解:(1)镁和二氧化碳在点燃条件下反应生成MgO和C,同时发出耀眼白光,所以看到的现象是:剧烈燃烧,发出耀眼白光,反应后在集气瓶内部附着白色粉末和黑色颗粒,反应方程式为:2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$C+2MgO.,
故答案为:剧烈燃烧,发出耀眼白光,反应后在集气瓶内部附着白色粉末和黑色颗粒;2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$C+2MgO;
(2)①Mg能在NO2中燃烧,产物为Mg3N2、Mg0和N2,装置A中Cu与浓硝酸反应生成的气体NO2,用装置B干燥剂干燥,通入硬质玻璃管C与镁粉发生反应,然后再干燥气体,用E装置除去多余的NO2,装置D排水法收集N2,故连接装置的顺序为:BCBED,用装置B干燥剂干燥,通入硬质玻璃管C与镁粉发生反应,然后再干燥气体,装置B中的作用是在C的两侧防止水蒸气进入C中与产物Mg3N2反应,
故答案为:BCBED;在C的两侧防止水蒸气进入C中与产物 Mg3N2反应;
②氮气不溶于水,如果有氮气,则能通过排水法收集到气体,所以确定产物中有N2生成的实验现象为D中试剂瓶中的水被气体压入烧杯中,
故答案为:D中试剂瓶中的水被气体压入烧杯中;
(3)①取C中少量反应后的固体产物,加入到水中产生有刺激性气味的气体,该气体能使湿润的红色石蕊试纸变成蓝色,证明产物中存在Mg3N2,
故答案为:取C中少量反应产物,加入到水中产生刺激性气味的气体,该气体可使湿润的红色石蕊试纸变蓝;
②NH3•H2O的电离常数与CH3COOH电离常数相等,均为1.75×10-5,所以醋酸铵溶液呈中性,将①中加水后的溶液加热,赶走NH3后,再加入过量的 CH3COONH4溶液,固体溶解,说明MgO和Mg(OH)2溶于铵盐溶液是与NH4+直接反应,不是与NH4+水解出来的H+反应,
故答案为:醋酸铵溶液呈中性,将①中加水后的溶液加热,赶走NH3后,再加入过量的CH3COONH4溶液,根据固体是否溶解分析判断.
点评 本题考查了物质性质的实验探究,理解实验原理、掌握实验基本操作和镁及其化合物性质是解题关键,题目难度中等.


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
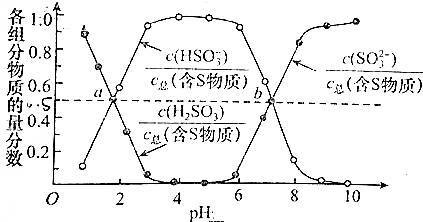
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 序号 | 实验目的 | 初始pH | 废水样品体积/mL | CuSO4溶液的体积/mL | 双氧水溶液的体积/mL | 蒸馏水的体积/mL |
| ① | 为以下实验操作参考 | 7 | 60 | 10 | 10 | 20 |
| ② | 废水的初始pH对破氰反应速率的影响 | 12 | 60 | 10 | 10 | 20 |
| ③ | 双氧水的浓度对破氰反应速率的影响 | 7 | 60 | 10 | 20 | 10 |
| 实验步骤(不要写出具体操作过程) | 预期实验现象和结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 生产中可用双氧水氧化法处理电镀含氰废水,某化学兴趣小组模拟该法探究有关因素对破氰反应速率的影响(注:破氰反应是指氧化剂将CN-氧化的反应).
生产中可用双氧水氧化法处理电镀含氰废水,某化学兴趣小组模拟该法探究有关因素对破氰反应速率的影响(注:破氰反应是指氧化剂将CN-氧化的反应).| 实验 序号 | 实验目的 | 初始pH | 废水样品体积/mL | CuSO4溶液的体积/mL | 双氧水溶液的体积/mL | 蒸馏水的体积/mL |
| ① | 为以下实验操作参考 | 7 | 60 | 10 | 10 | 20 |
| ② | 废水的初始pH对破氰反应速率的影响 | 12 | 60 | 10 | 10 | 20 |
| ③ | 双氧水的浓度对破氰反应速率的影响 | 7 | 60 | 10 | 20 | 10 |
| 实验步骤(不要写出具体操作过程) | 预期实验现象和结论 |
| 分别取等体积、等浓度的含氰废水于甲、乙两支试管中,再分别加入等体积、等浓度的双氧水溶液,只向甲试管中加入少量的无水硫酸铜粉末,用离子色谱仪测定相同反应时间内两支试管中的CN-浓度 | 相同时间内,若甲试管中的CN-浓度小于乙试管中的CN-浓度,则Cu2+对双氧水破氰反应起催化作用;若两试管中的CN-浓度相同,则Cu2+对双氧水破氰反应不起催化作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | .①②⑤ | B. | .①③④ | C. | .③④ | D. | ③④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH 4 | B. | C 2H 4 | C. | C 2H 6O | D. | C 6H 12O 6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
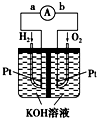 氢氧燃料电池是符合绿色化学理念的新型发电装置.如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定.请回答:
氢氧燃料电池是符合绿色化学理念的新型发电装置.如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定.请回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com