
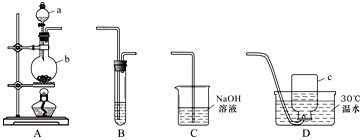
分析 (1)若b中盛放的固体是二氧化锰则a中为浓盐酸,混合加热反应生成氯气,氯气有毒污染空气需要通过氢氧化钠溶液吸收;
(2)①二氧化硫具有漂白性,可以使品红溶液褪色;二氧化硫具有氧化性可以优惠-2价硫为单质硫;
②二氧化硫具有还原性,可以使氧化剂高锰酸钾溶液褪色,二氧化硫被氧化为硫酸;
(3)集气瓶中收集到气体为NO,生成气体按照1:1生成,则3NO2+H2O=2HNO3+NO,设NO2物质的量为x,
得到生成NO为$\frac{x}{3}$mol,若集气瓶c中收集到的气体在标准状况下体积为 112 mL,物质的量=$\frac{0.112L}{22.4L/mol}$=0.005mol,x+$\frac{x}{3}$=0.005mol,x=0.00375mol,氮元素守恒计算得到;
解答 解:(1)在A、C之间连一个收集装置可以制取Cl2,若b中盛放的固体是二氧化锰,a中为浓盐酸,混合加热反应生成氯气,发生反应的化学方程式是:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,氯气有毒污染空气需要通过氢氧化钠溶液吸收,C中发生反应的离子方程式是:Cl2+2OH-═Cl-+ClO-+H2O,
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;Cl2+2OH-═Cl-+ClO-+H2O;
(2)①若B中盛放品红溶液,可以验证SO2的漂白性,能使品红溶液褪色,若B中盛放Na2S溶液,可以验证SO2的氧化性,2Na2S+2H2O+SO2=3S↓+4NaOH,溶液中生成淡黄色沉淀或乳白色沉淀,
故答案为:漂白; 氧化; 产生乳白色(淡黄色)沉淀;
②若B中盛放KMnO4溶液,可以验证SO2的还原性,反应的离子方程式为:5SO2+2MnO4-+2H2O═2Mn2++5SO42-+4H+,
故答案为:还原;5SO2+2MnO4-+2H2O═2Mn2++5SO42-+4H+;
(3)将A、D装置连接后,b中发生反应2NaNO2+2H2SO4═2NaHSO4+NO↑+NO2↑+H2O.
集气瓶中收集到气体为NO,生成气体按照1:1生成,则3NO2+H2O=2HNO3+NO,设NO2物质的量为x,
得到生成NO为$\frac{x}{3}$mol,若集气瓶c中收集到的气体在标准状况下体积为 112 mL,物质的量=$\frac{0.112L}{22.4L/mol}$=0.005mol,x+$\frac{x}{3}$=0.005mol,x=0.00375mol,
氮元素守恒得到b中参加反应的NaNO2质量=0.00375mol×2×69g/mol=0.52g,
故答案为:0.52.
点评 本题通过氯气、二氧化硫气体的制备,考查了氯气和二氧化硫的制备、净化、收集、性质的检验等,明确氯气和二氧化硫制备原理、氯气和二氧化硫的性质是解题关键,题目难度中等.


 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案科目:高中化学 来源: 题型:选择题
| A. | 如果a1=a2,b1=b2,则混合溶液中c(CH3COO-)=c(Na+) | |
| B. | 如果混合溶液的PH=7,则混合溶液中c(CH3COO-)>c(Na+) | |
| C. | 如果混合溶液的PH<7,则a1b1=a2b2 | |
| D. | 如果a1=a2,且混合溶液的PH<7,则b1>b2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol/L氨水中:c(NH4+)+c(H+)═c(OH-) | |
| B. | 0.1 mol/L的NH4Cl溶液中:c(NH4+)═c(Cl-) | |
| C. | 同为0.1 mol/L的硫酸和氨水等体积混合后:c(NH4+)+c(NH3•H2O)═2c(SO42-) | |
| D. | pH=3的盐酸和pH=11的氨水等体积混合后:c(OH-)=c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Zn、CuO | B. | Fe、Al2O3 | C. | Fe、CuO | D. | Cu、FeO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com