
| A. | ①和② | B. | ①和③ | C. | ②和③ | D. | 只有③ |
分析 化学变化是指在原子核不变的情况下,有新物质生成的变化,物理变化是指没有新物质生成的变化,化学变化和物理变化的本质区别在于是否有新物质生成.
解答 解:①加热熔融或粉碎是物理变化,没有新物质生成,故①错误;
②解聚成小分子物质,小分子物质又可循环再用于制造新的塑料有新物质生成,属于化学变化,故②正确;
③催化裂解是指通过热能将一种样品(主要指高分子化合物)转变成另外几种物质(主要指低分子化合物)的化学过程,过程中有新物质生成,属于化学变化,故③正确;
故选C.
点评 本题考查判断物理变化与化学变化的区别与联系,难度不大,变化后是否有新物质生成,是判断物理变化和化学变化的基本依据.


科目:高中化学 来源: 题型:解答题
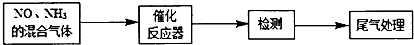
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用温水泡加酶洗衣粉 | |
| B. | 长期保存食用油应隔绝空气 | |
| C. | 使用加碘(KIO3)食盐时避免高温 | |
| D. | 可以在装饰材料中大量添加甲醛、苯等物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3M(气)+2N(气)?P(气)+4Q(气) | B. | M(气)+2N(气)?3P(气)+Q(固) | ||
| C. | M(气)+N(气)?P(气) | D. | 以上都达到平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
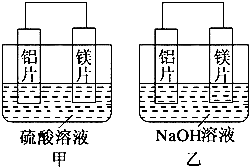
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钡溶液和稀硫酸的反应:Ba2++OH-+H++SO42-=BaSO4↓+H2O | |
| B. | 大理石和稀盐酸反应:2H++CO32-=H2O+CO2↑ | |
| C. | 醋酸和氢氧化钠的反应:CH3COOH+OH-=CH3COO-+H2O | |
| D. | 铜和稀硫酸反应:Cu+2H+=Cu2++H2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com