
以NA代表阿伏加德罗常数.关于热化学方程式:C2H2(g)+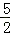 O2(g)=2CO2(g)+H2O(l)△H=﹣1300kJ/mol的说法正确的是
O2(g)=2CO2(g)+H2O(l)△H=﹣1300kJ/mol的说法正确的是
( )
|
| A. | 有10NA个电子转移时,该反应放出1300kJ的能量 |
|
| B. | 有NA个水分子生成且为液体时,吸收1300kJ的能量 |
|
| C. | 有2NA个碳氧共用电子对生成时,放出1300kJ的能量 |
|
| D. | 有8NA个碳氧共用电子对生成时,放出1300kJ的能量 |
| 热化学方程式. | |
| 专题: | 化学反应中的能量变化. |
| 分析: | A.10NA个电子的物质的量为10mol,反应中碳元素的化合价由﹣1价升高为+4,据此计算参加反应的乙炔的物质的量,结合热化学方程式计算; B.热化学方程式中△H<0表示放热,该反应为放热反应; C.2NA对碳氧共用电子对的物质的量为2mol,1个CO2分子含有4对碳氧共用电子对,据此计算CO2的物质的量,结合热化学方程式计算; D.4NA对碳氧共用电子对的物质的量为4mol,1个CO2分子含有4对碳氧共用电子对,据此计算CO2的物质的量,结合热化学方程式计算; |
| 解答: | 解:A.10NA个电子的物质的量为10mol,反应中碳元素的化合价由﹣1价升高为+4,参加反应的乙炔的物质的量为 B.热化学方程式中△H<0表示放热, C2H2(g)+ C.1个CO2分子中含有4个共用电子对,有8NA个碳氧共用电子对生成时,说明有2molCO2生成,放出1300KJ的能量,有2NA个碳氧共用电子对生成时,说明有0.5molCO2生成,放出 D.1个CO2分子中含有4个共用电子对,有8NA个碳氧共用电子对生成时,说明有2molCO2生成,放出1300KJ的能量,故D正确; 故选AD. |
| 点评: | 本题考查了对热化学方程式的理解的有关计算,注意从微观结构判断参加反应物质的物质的量是做本题的关键,题目难度中等. |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
实验室欲配制0.5mol•L﹣1的NaOH溶液500ml有下列仪器:①烧杯②100ml量筒③1000ml容量瓶④500ml容量瓶⑤玻璃棒⑥托盘天平(带砝码)⑦药匙
(1)配制时,必须使用的仪器有填代号,还缺的仪器是,该实验中两次用到玻璃棒,其作用分别是搅拌、.
(2)使用容量瓶之前必须进行的操作是.
查看答案和解析>>
科目:高中化学 来源: 题型:
分析下面的能量变化示意图,下列热化学方程式正确的是( )

A.2A(g)+B(g)===2C(g) ΔH=a(a>0)
B.2A(g)+B(g)===2C(g) ΔH=a(a<0)
C.2A+B===2C ΔH=a(a<0)
D.2C===2A+B ΔH=a(a>0)
查看答案和解析>>
科目:高中化学 来源: 题型:
已知1g氢气完全燃烧生成水蒸气时放出热量121kJ,且氧气中1mol O=O键完全断裂时吸收热量496kJ,水蒸气中1mol H﹣O键形成时放出热量463kJ,则氢气中1mol H﹣H键断裂时吸收热量为( )
|
| A. | 920kJ | B. | 557kJ | C. | 436kJ | D. | 188kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:
CaCO3与稀盐酸反应(放热反应)生成CO2的量与反应时间的关系如图所示.下列结论不正确的是( )
|
| A. | 反应开始2分钟内平均反应速率最大 |
|
| B. | 反应4分钟后平均反应速率最小 |
|
| C. | 反应开始4分钟内温度对反应速率的影响比浓度大 |
|
| D. | 反应4分钟后反应速率下降的原因是盐酸浓度逐渐减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
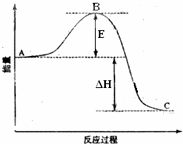
22SO2(g)+O2(g)⇌2SO3(g)反应过程的能量变化如图所示.
已知1mol SO2(g)氧化为1mol SO3的△H=﹣99kJ•mol﹣1.请回答下列问题:
(1)图中C表示 ;该反应通常用V2O5作催化剂,加V2O5会使图中B点降低,理由是 ;
(2)图中△H= kJ•mol﹣1;
(3)如果反应速率υ(SO2)为0.05mol•L﹣1•min﹣1,则υ(O2)= mol•L﹣1•min﹣1;
(4)已知单质硫的燃烧热为296KJ•mol﹣1,计算由S(s)生成3mol SO3(g)的△H= .
查看答案和解析>>
科目:高中化学 来源:2014-2015陕西省西安市高一上学期期末考试化学试卷(解析版) 题型:填空题
(7分)(1)在一个白色点滴板的二个孔穴中分别加入火柴梗、少量CuSO4·5H2O。分别滴入几滴浓硫酸,观察现象。回答下列问题:
浓硫酸滴到火柴梗上,火柴梗变 ________(填实验现象),说明浓硫酸具有________性。
浓硫酸滴入CuSO4·5H2O中,胆矾 (填实验现象),说明浓硫酸具有_________性。
(2)为探究Fe3+能转化为Fe2+,实验室提供下列试剂:铁粉、0.1mol·L-1 FeCl3溶液、0.1mol·L-1 FeCl2溶液、KSCN溶液、新制氯水。请你就实验操作、实验现象、结论完成以下填空:
取少量 溶液于试管中,加入足量 ,充分振荡后静置,滴加1至2滴 ,无明显变化,说明Fe3+已转化为Fe2+。
查看答案和解析>>
科目:高中化学 来源:2014-2015陕西省西安市高一上学期期末考试化学试卷(解析版) 题型:选择题
澄清透明溶液中能大量共存的离子组是
A.HCO3-、Na+、K+、H+ B.NO3-、Cu2+、Na+、OH-
C.Al3+、K+、NO3-、OH- D.Fe3+、H+、Na+、Cl-
查看答案和解析>>
科目:高中化学 来源:2014-2015宁夏银川市高一下学期3月月考化学试卷(解析版) 题型:选择题
将一定量的锌与100mL 18.5mol/L浓硫酸充分反应后,锌完全溶解,同时生成气体A为33.6L(标准状况).将反应后的溶液稀释至1L,测得溶液的c(H+)=0.1mol·L-1,则下列叙述中错误的是
A.气体A为SO2和H2的混合物 B.气体A中SO2和H2的体积比为4:1
C.反应中共消耗Zn 97.5g D.反应中共转移3mol电子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com