
| 化学键 | C-Cl | C-Br |
| 键能(kJ•mol-1) | 330 | 276 |
| 化合物 | AgCl | AgBr |
| Ksp近似值 | 1.8×10-10 | 5×10-13 |
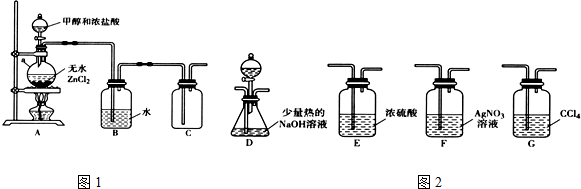
分析 (1)①甲醇与浓盐酸在氯化铝作催化剂的条件下发生取代反应生成一氯甲烷和水;
②氯化氢易挥发,所以要用水除去一氯甲烷中的氯化氢;
③根据题意,一氯甲烷燃烧产生氯化氢,根据与之反应的氢氧化钠的物质的量可求得氯化氢的物质的量,进而确定一氯甲烷的物质的量;
(2)根据题意,检验CH3Cl中的氯元素,可以将一氯甲烷通入到热的氢氧化钠溶液中,反应一段时间后再加入用硝酸酸化的硝酸银溶液,根据是否有白色沉淀生成可判断氯元素的存在;
(3)根据题意,CH3X通入AgNO3的乙醇溶液中,能生成硝酸甲酯和AgX,根据沉淀的溶解平衡可知,溶度积大的物质可以转化成溶度积小的,据此答题.
解答 解:(1)①甲醇与浓盐酸在氯化铝作催化剂的条件下发生取代反应生成一氯甲烷和水,反应的化学方程式为CH3OH+HCl$→_{△}^{ZnCl_{2}}$CH3Cl+H2O,
故答案为:CH3OH+HCl$→_{△}^{ZnCl_{2}}$CH3Cl+H2O;
②氯化氢易挥发,所以要用水除去一氯甲烷中的氯化氢,所以装置B的主要作用是除去氯化氢气体,
故答案为:除去氯化氢气体;
③根据题意,与氯化氢反应的氢氧化钠的物质的量为c1V1×10-3mol-c2V2×10-3mol,所以一氯甲烷燃烧产生氯化氢的物质的量为c1V1×10-3mol-c2V2×10-3mol,则一氯甲烷的物质的量为(c1V1-c2V2)×10-3mol,
故答案为:(c1V1-c2V2)×10-3;
(2)根据题意,检验CH3Cl中的氯元素,可以将一氯甲烷通入到热的氢氧化钠溶液中,反应一段时间后再加入用硝酸酸化的硝酸银溶液,根据是否有白色沉淀生成可判断氯元素的存在,
①根据上面的分析可知,装置依次连接的合理顺序为A、B、F、D、G,
故答案为:F、D、G;
②根据上面的分析可知,分液漏斗中盛放的试剂是硝酸、硝酸银,
故答案为:硝酸、硝酸银;
③能证明CH3Cl中含有氯元素的实验现象是F中无白色沉淀生成,D中有白色沉淀生成,
故答案为:F中无白色沉淀生成,D中有白色沉淀生成;
(3)根据题意,CH3X通入AgNO3的乙醇溶液中,能生成硝酸甲酯和AgX,根据沉淀的溶解平衡可知,溶度积大的物质可以转化成溶度积小的,
①硝酸甲酯的结构简式为:CH3ONO2,
故答案为:CH3ONO2;
②依据表中数据可知,C-Br键的键能小,更容易断裂,同时溴化银的溶度积常数更小,溴化银更容易形成沉淀,所以先出现淡黄色溴化银沉淀,
故答案为:C-Br键的键能小,更容易断裂,同时溴化银的溶度积常数更小,溴化银更容易形成沉淀;
点评 本题考查甲烷和氯气的取代反应、氯气的实验室制法,沉淀的溶解平衡,实验方案的设计等,理解实验的原理是解题关键,题目难度中等.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
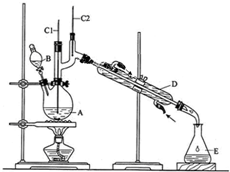
| 沸点/℃ | 密度/g•cm-3 | 水中溶解性 | |
| 正丁醇 | 117.2 | 0.8109 | 微溶 |
| 正丁醛 | 75.7 | 0.8017 | 微溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如图:
醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如图:| 相对分子质量 | 密度/(g•cm3) | 沸点/℃ | 溶解性 | |
| 环己醇 | 100 | 0.9618 | 161 | 微溶于水 |
| 环己烯 | 82 | 0.8102 | 83 | 难溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
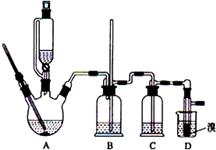 实验室制备1,2-二溴乙烷的反应原理如下:
实验室制备1,2-二溴乙烷的反应原理如下:| 乙醇 | 1,2-二溴乙烷 | 乙醚 | 液溴 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 | 红色发烟液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 | 3.12 |
| 沸点/℃ | 78.5 | 132 | 34.6 | 58.8 |
| 熔点/℃ | -l30 | 9 | -1l6 | -7.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤ | B. | ①③⑤④② | C. | ①⑤④③② | D. | ①②⑤③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K越大,反应达到平衡时所用的时间越短 | |
| B. | K越小,达到平衡时,反应物的 转化率越大 | |
| C. | K随反应物浓度改变而改变 | |
| D. | K越大,达到平衡时,反应进行的程度越大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com