
分析 (1)依据热化学方程式和盖斯定律计算得到所需热化学方程式;
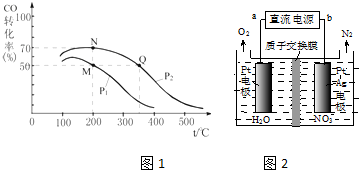
(2)①M点时,CO转化率为50%,则参加反应的n(CO)=10mol×50%=5mol,还剩余5molCO,根据方程式知,还剩余n(H2)=20mol-5mol×2=10mol,生成n(CH3OH)=5mol;N点时,CO转化率为70%,参加反应的n(CO)=10mol×70%=7mol,还剩余3molCO,根据方程式知,还剩余n(H2)=20mol-7mol×2=6mol,生成n(CH3OH)=7mol,据此计算其物质的量之比;
②化学平衡常数只与温度有关,相同温度时其平衡常数相等,升高温度平衡向逆反应方向移动,其平衡常数减小;
(3)①用H2将NO3-还原为N2,一段时间后,溶液的碱性明显增强,说明该反应中生成氢氧根离子;
②根据图象知,硝酸根离子得电子发生还原反应,则b为负极、a为正极,根据电池反应式知,阴极上硝酸根离子得电子生成氮气和水.
解答 解:(1)①H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H1=-241.8kJ•mol-1
②C(s)+$\frac{1}{2}$O2(g)═CO(g)△H2=-110.5 kJ•mol-1
依据盖斯定律计算②-①得到焦炭与水蒸气反应生成CO的热化学方程式为C(s)+H2O(g)=CO(g)+H2(g)△H=+131.3kJ•mol-1;
故答案为:C(s)+H2O(g)=CO(g)+H2(g)△H=+131.3kJ•mol-1;
(2)①M点时,CO转化率为50%,则参加反应的n(CO)=10mol×50%=5mol,还剩余5molCO,根据方程式知,还剩余n(H2)=20mol-5mol×2=10mol,生成n(CH3OH)=5mol;N点时,CO转化率为80%,参加反应的n(CO)=10mol×70%=7mol,还剩余3molCO,根据方程式知,还剩余n(H2)=20mol-7mol×2=6mol,生成n(CH3OH)=7mol,所以容器中总物质的物质的量之比为:n(M)总:n(N)总=(5+10+5)mol:(3+6+7)mol=5:4,
故答案为:5:4;
②化学平衡常数只与温度有关,相同温度时其平衡常数相等,升高温度平衡向逆反应方向移动,其平衡常数减小,根据图象知,温度:M=N<Q,则若M、N、Q三点的平衡常数KM、KN、KQ的大小关系为KM=KN>KQ,故答案为:KM=KN>KQ;
(3)①用H2将NO3-还原为N2,一段时间后,溶液的碱性明显增强,说明该反应中生成氢氧根离子,同时还生成水,所以反应方程式为2NO3-+5H2$\frac{\underline{\;催化剂\;}}{\;}$N2+2OH-+4H2O,
故答案为:2NO3-+5H2$\frac{\underline{\;催化剂\;}}{\;}$N2+2OH-+4H2O;
②根据图象知,硝酸根离子得电子发生还原反应,则b为负极、a为正极,根据电池反应式知,阴极上硝酸根离子得电子生成氮气和水,电极反应式为2NO3-+12H++10e-=N2+6H2O,
故答案为:a;2NO3-+12H++10e-=N2+6H2O.
点评 本题考查化学平衡及电解原理,知道化学平衡状态判断方法、温度与化学平衡常数的关系、外界条件对化学平衡的影响、电解原理等知识点分析解答即可,只有反应前后改变的物理量才能作为化学平衡状态的判断依据,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. |  四种基本反应类型有氧化还原反应的关系 | |
| B. |  AlCl3溶液中滴加NaOH溶液生成沉淀的情况 | |
| C. |  Ba(OH)2溶液中滴加硫酸溶液时的导电性情况 | |
| D. |  等体积、等浓度的稀硫酸分别与足量的铁和镁反应的情况 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 3.7 | 9.6 |
| 完全沉淀pH | 3.7 | 4.7 | 11 |
| 温度/℃ | 0 | 10 | 20 | 50 | 75 | 100 |
| Li2CO3的溶解度/g | 1.539 | 1.406 | 1.329 | 1.181 | 0.866 | 0.728 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在28 g聚乙烯树脂中,含有的碳原子数目为2NA | |
| B. | 在合成28 g聚乙烯树脂的单体中,含有的双键数目为NA | |
| C. | 28 g聚乙烯树脂完全燃烧时,转移的电子数目为3NA | |
| D. | 28 g聚乙烯树脂中,含有的C-H键的数目为4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 锌是负极,其质量逐渐减小 | B. | 氢离子在铜表面被还原,产生气泡 | ||
| C. | 电子从锌片经导线流向铜片 | D. | 电子从锌片经硫酸溶液流向铜片 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 26.0kJ | B. | 155.8kJ | C. | 51.9kJ | D. | 467.3kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AgNO3 | B. | Ca(OH)2 | C. | Na2SO3 | D. | AlCl3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com