

分析 (1)SO2与O2的反应为放热反应,为了充分利用能量,应安装热交换器;吸收塔中填充许多瓷管,增大三氧化硫与浓硫酸的接触面,有利于三氧化硫的吸收.
(2)根据反应过程分布计算;
(3)A、硫铁矿中铁的氧化需要消耗O2;
B、原料选择与SO2的转化率无关;
C、用硫铁矿为原料产生的废渣较多,但废气量相同;
D、用SO2制取SO3的过程中都需要使用催化剂;
(4)A、橡胶硫化所用到的为单质硫;
B、烷基苯磺酸钠中含有磺酸基,制取过程中需要发生磺化反应;
C、铅蓄电池中需要用到硫酸和硫酸铅;
D、过磷酸钙的制取过程中需要浓硫酸和磷矿石;
(5)CaCO3高温分解生成CO2和CaO,SO2为酸性氧化物,可以和碱性氧化物CaO反应生成CaSO3,而CaSO3易被氧化为CaSO4.
解答 解:(1)SO2与O2的反应为放热反应,为了充分利用能量,应安装热交换器;吸收塔中填充许多瓷管,增大三氧化硫与浓硫酸的接触面,有利于三氧化硫的吸收,
故答案为:热交换器;使浓H2SO4与SO3充分接触;
(2)燃烧室中的反应为S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2,假设SO2的体积为x,则流量计1中通入氧气的体积为1.5x,接触室中的反应为2SO2+O2$\frac{\underline{催化剂}}{△}$2SO3,则流量计2中通入氧气的体积为1.25x;流量计1中通入空气的体积为7.5x,流量计2中通入空气的体积为6.25x,故流经流量计1和流量计2的空气体积比应为7.5x:6.25x=6:5;燃烧室剩余空气6.5x,接触室剩余空气6.25x-x=5.775x,剩余SO2为0.05x,故b管尾气中SO2的体积分数为0.41%;SO2为酸性氧化物,可以用碱液(如氨水)吸收,
故答案为:6:5;0.41%; 用氨水吸收;
(3)硫铁矿中铁的氧化需要消耗O2,A项正确;原料选择与SO2的转化率无关,B项错误;用硫铁矿为原料产生的废渣较多,但废气量相同,C项错误;用SO2制取SO3的过程中都需要使用催化剂,D项错误,
故选A,
故答案为:A;
(4)橡胶硫化所用到的为单质硫,A项错误;烷基苯磺酸钠中含有磺酸基,制取过程中需要发生磺化反应,B项正确;铅蓄电池中需要用到硫酸和硫酸铅,C项正确;过磷酸钙的制取过程中需要浓硫酸和磷矿石,D项正确,
故选BCD,
故答案为:BCD;
(5)CaCO3高温分解生成CO2和CaO,SO2为酸性氧化物,可以和碱性氧化物CaO反应生成CaSO3,而CaSO3易被氧化为CaSO4,所以发生反应的化学方程式为:CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑ SO2+CaO═CaSO3 2CaSO3+O2═2CaSO4,
故答案为:CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑、SO2+CaO═CaSO3、2CaSO3+O2═2CaSO4.
点评 本题是对化学与技术及工业生产的考查,需要学生细读生产工艺图中各物质的变化进行解答,把握氨碱法、制备浓硫酸的工艺流程及设备的作用、发生的化学反应为解答的关键,题目难度中等.


科目:高中化学 来源: 题型:多选题
| A. |  =KCl+3Cl2↑+3H2O =KCl+3Cl2↑+3H2O | |
| B. | H2S+H2SO4(浓)═S↓+SO2↑+2H2O | |
| C. | 2H2S+SO2═3S↓+2H2O中氧化剂与还原剂的物质的量之比是1:2 | |
| D. | 3NO2+H2O═2HNO3+NO中氧化剂与还原剂的物质的量之比是1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
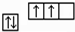 ;其2p能级的轨道有3个伸展方向,电子云的形状为纺锤形.
;其2p能级的轨道有3个伸展方向,电子云的形状为纺锤形.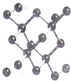
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
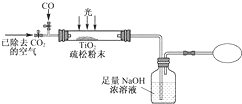
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2将完全转化为NH3 | |
| B. | N2、H2、和NH3的物质的量浓度相等 | |
| C. | N2、H2、和NH3的物质的量浓度不在变化 | |
| D. | 正反应和逆反应的速率都为零 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 ,由上述实验可知,该溶液中可以肯定存在的离子有SO32-、S2-、CO32-.
,由上述实验可知,该溶液中可以肯定存在的离子有SO32-、S2-、CO32-.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com