
【题目】I:氢化亚铜(CuH)是一种难溶物质,用CuSO4溶液和“另一物质”在40~50℃时反应可生成它。CuH不稳定、易分解、在氯气中能燃烧,与稀盐酸反应能生成气体;Cu+在酸性条件下发生的反应是2Cu+= Cu2++Cu。根据以上信息回答:
(1)用CuSO4溶液和“另一物质”制CuH的反应中,用氧化还原观点分析,这“另一物质”在反应中所起的作用是____________。
(2)写出CuH在氯气中燃烧的化学反应方程式_________________。
(3)CuH溶解在稀盐酸中生成的气体是______________,如果反应中生成了标准状况下22.4 L的气体,被还原的离子得电子的物质的量是__________。
II:用高效的二氧化氯(ClO2)替代液氯进行消毒,可避免产生对人体健康有害的有机氯代物。
(1)工业上,ClO2常用NaClO3和Na2SO3溶液混合并加硫酸酸化后反应制得,则化学反应方程式为__________________________。
(2) 有效氯含量是含氯消毒剂的一个重要指标,有效氯含量的定义:从HI中氧化出相同量的I2所需Cl2的质量与指定含氯消毒剂的质量之比,常用百分数表示。则ClO2的有效氯含量是___________。
(3)某同学欲对用ClO2消毒过的自来水进行氯元素含量的测定(假定ClO2全部转化为Cl-),他进行了如下实验:向30.00 mL水样中加几滴K2CrO4溶液作指示剂,用0.001 mol·L-1 AgNO3溶液滴定,当有砖红色Ag2CrO4沉淀出现时,达滴定终点,此时用去AgNO3溶液12.12 mL。
①水样中Cl-的物质的量浓度是__________。
②已知Ksp(AgCl)=1.78×10-10,Ksp(Ag2CrO4)=2.00×10-12。如在滴定终点时,测得溶液中CrO42-的浓度是5.0×10-3mol·L-1。试计算此时溶液中Cl-的浓度是_________。
【答案】Ⅰ:(1)还原剂(1分)
(2)2CuH+3Cl2![]() 2CuCl2+2HCl(2分)
2CuCl2+2HCl(2分)
(3)H2 1.5mol(2分)
II:(1)2NaClO3+Na2SO3+H2SO4=2Na2SO4+2ClO2↑+H2O(2分)
(2)263%(或2.63)(1分)
(3)①4.04×10-4mol·L-1②8.9×10-6mol·L-1(2分)
【解析】Ⅰ:(1)用CuSO4溶液和“另一物质可以”制CuH,由于在CuSO4中Cu元素的化合价是+2价,反应后变为CuI中的+1价,化合价降低,得到电子,CuSO4作氧化剂,则另一物质在该反应中要失去电子,作还原剂,表现还原性;
(2)CuH在氯气中燃烧产生CuCl2和HCl,反应的化学反应方程式是2CuH+3Cl2![]() 2CuCl2+2HCl;
2CuCl2+2HCl;
(3)CuH溶解在稀盐酸中发生氧化还原反应,产生CuCl2和氢气,反应的方程式是2CuH+2HCl=CuCl2+2H2↑+Cu,因此生成的气体是H2。如果反应中生成了标准状况下22.4 L的气体,即产生了1mol氢气,被还原的离子得电子的物质的量是1mol+0.5mol=1.5mol;
II:(1)反应中亚硫酸钠是还原剂,硫酸钠是氧化产物,氯酸钠是氧化剂,二氧化氯是还原产物,反应的方程式为2NaClO3+Na2SO3+H2SO4=2Na2SO4+2ClO2↑+H2O;
(2)由Cl2+2HI=I2+2HCl、2ClO2+10HI=2HCl+5I2+4H2O可知,均生成5molI2时需要氯气、二氧化氯的物质的量比为5:2,所以ClO2的有效氯含量为(5×71 g·mol—1)/(2×67.5 g·mol—1)×100%=263%(或2.63)。
(3)①由Ag++Cl=AgCl↓可知,n(Cl-)=12.12×0.001L×0.001000molL-1=12.12×10-6mol,所以水样中c(Cl-)=12.12×106mol/30×103L=4.04×10-4 molL-1;
②当c(CrO42-)=5.0×10-3mol·L-1出现砖红色沉淀时,由Ksp(Ag2CrO4)和 c(CrO42-)=5.00×10-3,得c(Ag+)=![]() mol/L=2.00×10-5 molL-1,所以c(Cl-)=1.78×1010/2.00×105=8.90×10-6 molL-1。
mol/L=2.00×10-5 molL-1,所以c(Cl-)=1.78×1010/2.00×105=8.90×10-6 molL-1。


科目:高中化学 来源: 题型:
【题目】断裂1 mol化学键所需的能量如下:
化学键 | N—N | O=O | N≡N | N—H |
键能(kJ) | 154 | 500 | 942 | a |
火箭燃料肼(H2N—NH2)的有关化学反应的能量变化如图所示,则下列说法错误的是( )
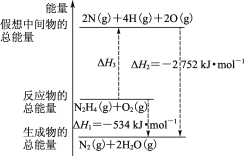
A.N2比O2稳定
B.N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH=-534 kJ·mol-1
C.表中的a=194
D.图中的ΔH3=+2218 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W的原子序数依次增大。在下图所示物质转化关系中,l是由该四种元素组成的离子化合物,m是Y的单质,n是Z的单质,m、n均为空气的主要成分,p是W的单质,其余为由上述的两种或三种元素组成的化合物;u的水溶液具有漂白性;t和v均为一元强酸。

下列说法正确的是
A. 物质u中既含共价键又含离子键
B. 常温常压下,r与s均为无色气体
C. 简单气态氢化物的热稳定性:Z
D. X、Y、Z三种元素形成化合物的水溶液可能呈酸性,也可能呈碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是巨大的资源宝库,海水资源的利用和海水化学资源的利用具有非常广阔的前景。从海水中提取食盐和溴的过程如下:

(1)请列举海水淡化的两种方法:____、____。
(2)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,其目的为_______。
(3)步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式为_______。
(4)某化学研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料,Br2的沸点为59℃。微溶于水,有毒性和强腐蚀性。他们参观生产过程后,绘制了如下装置简图。

请你参与分析讨论:
①图中仪器B的名称:___。
②实验装置中使用热水浴的原因是_________________。
③C中液体产生颜色为____。为除其物中仍残留的少量Cl2,可向其中加入NaBr溶液,反应的化学方程式为_________________________充分反应后,再进行的分离操作是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三硫化磷(P4S3)是黄绿色针状晶体,易燃、有毒,分子结构之一如图所示,已知其燃烧时P被氧化为P4010,下列有关P4S3的说法中不正确的是

A. P4S3中磷元素为+3价
B. P4S3属于共价化合物
C. P4S3充分燃烧的化学方程式为P4S3+8O2=P4O10+3SO2
D. 1mol P4S3分子中含有9mol共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[2017海南][双选]下列实验操作正确的是
A.滴定前用待测液润洗锥形瓶
B.容量瓶和滴定管使用前均需要检漏
C.蒸馏完毕时,先关闭冷凝水,再停止加热
D.分液时,下层溶液先从下口放出,上层溶液再从上口倒出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A. 向MgCl2溶液中滴加过量氨水:Mg2++2OH-=Mg(OH)2↓
B. 用稀硝酸洗涤试管内壁的银镜:Ag+4H++NO![]() =Ag++NO↑+2H2O
=Ag++NO↑+2H2O
C. 将Cu粉加入到Fe2(SO4)3溶液中:2Fe3++3Cu=2Fe+3Cu2+
D. 向NaAlO2溶液中通入过量CO2:AlO![]() +CO2+2H2O=Al(OH)3↓+HCO
+CO2+2H2O=Al(OH)3↓+HCO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[2016全国Ⅲ]下列有关实验的操作正确的是
实验 | 操作 | |
A. | 配制稀硫酸 | 先将浓硫酸加入烧杯中,后倒入蒸馏水 |
B. | 排水法收集KMnO4分解产生的O2 | 先熄灭酒精灯,后移出导管 |
C. | 浓盐酸与MnO2反应制备纯净Cl2 | 气体产物先通过浓硫酸,后通过饱和食盐水 |
D. | CCl4萃取碘水中的I2 | 先从分液漏斗下口放出有机层,后从上口倒出水层 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硒(Se),是一种非金属元素。可以用作光敏材料、电解锰行业催化剂、动物体必需的营养元素和植物有益的营养元素等。请回答下列问题:
(1) Se原子的核外电子排布式为____________。
(2) 比较As的第一电离能比Se______(填“大”或“小”)。
(3) SeO42-中Se-O的键角比SeO3的键角____(填“大”或“小”)原因是______________
(4) H2SeO4比H2SeO3水溶液的酸性___________。
(5) 硒单质是红色或灰色粉末,带灰色金属光泽的准金属,灰硒的晶体为六方晶胞结构,原子排列为无限螺旋链,分布在六方晶格上,同一条链内原子作用很强,相邻链之间原子作用较弱,其螺旋链状图、晶胞结构图和晶胞俯视图如下。
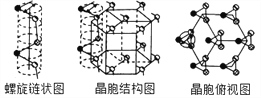
螺旋链中Se原子的杂化方式为__________。己知正六棱柱的边长为acm,高为b cm,阿伏加德罗常数为NAmol-1,则该晶胞中含有的Se原子个数为_________,该晶体的密度为___________g/cm3 (用含NA、a、b的式子表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com