
����ѧ��ѡ��3�����ʽṹ�����ʡ�����ǰ����������Ԫ��X��Y��Z��E��F��G�����ǵ�ԭ��������������G�⣬��������Ԫ�ض��Ƕ�����Ԫ�ء�X��Y��E����Ԫ����ɵĻ�������ʵ���ҳ���ȼ�ϡ�ȡF�Ļ���������ɫ��Ӧʵ�飬����ɫ�ʻ�ɫ��G�ĵ����������г�����һ�ֽ�����GE�Ǻ�ɫ���塣��ش��������⣺
��1��д����̬Gԭ�ӵ����Ų�ʽ�� ��Y��Z��E��F��G�ĵ�һ������������ ����Ԫ�ط��ű�ʾ����
��2��X��Y��Z�γ�3ԭ�ӷ���M��ÿ��ԭ�Ӽ۲���Ӿ��ﵽ�ȶ��ṹ��M���ӵĽṹʽΪ ��1molM�� ����ĿΪ ��
����ĿΪ ��
��3�����ݼ۲���ӶԻ������ۣ�VESPR���Ʋ⣺ZE2-�����幹��Ϊ ��YE32-������ԭ���ӻ�����Ϊ ��
��4��Z��X�γɵļ����K���ܽ���E��X�γɵļ������ԭ����________��
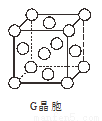
��5��G�����ṹ��ͼ��ʾ����֪��������ⳤΪapm��G �����ܶ�Ϊbg��cm-3�����ӵ�����NA= ���ú�a��b�Ĵ���ʽ��ʾ����

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ������������ѧ��һ�����л�ѧ�Ծ��������棩 ���ͣ�ѡ����
X��Y��Z���ֽ�����X��Y���ԭ��أ�X�Ǹ�������Y����Z����������Һ�У�Y������Z�����������˳���ǣ� ��
A��X>Y>Z B��Z>Y>X C��X>Z>Y D��Y>X>Z
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016������ʡ������������Ӧ�Կ������ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
��NAΪ�����ӵ�������ֵ������˵����ȷ����
A��һ�������£���1 mol N2��3 mol H2��Ϸ�����Ӧ��ת�Ƶĵ�������Ϊ6 NA
B��1 L 0.1 mol��L��1��Na2CO3��Һ�������ӵ���������0.1 NA
C����FeI2��Һ��ͨ������Cl2������2 mol Fe2��������ʱ������Cl2�ķ�����ΪNA
D��1 mol��CH3�������ĵ�������Ϊ10 NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�켪��ʡ�����ڶ���ģ�����ۻ�ѧ�Ծ��������棩 ���ͣ�ʵ����
����ѧ����ѡ��2����ѧ�뼼����
����刺��������ʡ�����ըҩ��ɱ������䶳���ȣ���ҵ��ȡ����淋Ĺ����������£�
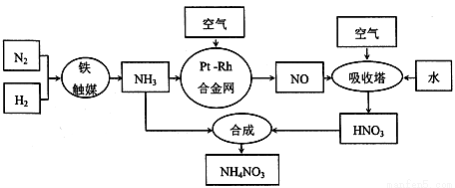
��l���ϳɰ����Ĺ�ҵ�豸������__________���豸�������Ƚ�������Ŀ����_______________���ϳɰ���ԭ��������������Ŀ����_________________________________��
��2���������з�Ӧ�Ļ�ѧ����ʽΪ___________________�����������̿�������������Ҫ�����������ԭ����__________________________��
��3����������Ĺ����г��������������������������ַ���������
����һ��������Һ���շ�
NO��NO2��2NaOH=2NaNO2��H2O��2NO2��Na2CO3=NaNO2��NaNO3��CO2
��������NH3��ԭ��
8NH3(g)+6NO2(g)=7N2(g)+12H2O(g) ��H =��2635 kJ/mol��NOҲ�����Ƶķ�Ӧ��
���������������շ�
CH4(g)+2NO2=CO2(g)+N2+2H2O(g) ��H=+867 kJ/mol��NOҲ�����Ƶķ�Ӧ��
�������ַ����У�����һ����Ҫȱ����_______________________________��
�������ͷ�������ȣ���������ȱ����_________________________��
��4����ҵ��Ҳ����ͨ�����NO�Ʊ�NH4NO3���乤��ԭ������ͼ��ʾ��
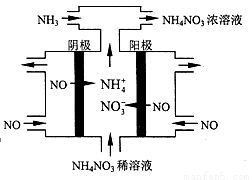
��ͼ��ͨ��NH3��Ŀ����_____________��
����ά�ֵ���ǿ��Ϊ3A�����2Сʱ�������Ͽ��Ƶ�NH4NO3���������Ϊ_________g��
����֪F=96500 C��mol��l��������2λ��Ч���֣���
��5��ij���ʳ���NH3�Ʊ�NH4NO3����֪��NH3��NO�IJ�����94����NO��HNO3�IJ�����89��������HNO3����NH3������ռ�ܺ�NH3������������������ģ��İٷֱ�Ϊ______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�켪��ʡ�����ڶ���ģ�����ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
������Ԫ��X��Y��Z��W��Ԫ�����ڱ��е����λ����ͼ��ʾ������Z������������������������2���������жϲ���ȷ����
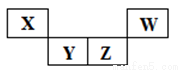
A����������ϼۣ�X<Y<Z
B��ԭ�Ӱ뾶��X<Y<Z
C����̬�⻯������ȶ��ԣ�Z<W
D������������Ӧˮ��������ԣ�X<Z
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�콭���ϲ����С��ٴ�һ�еȸ���4�����������ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
T��ʱ����һ�̶��ݻ����ܱ������з�����Ӧ��A(g)+B(g)  C(s) ��H<0������
C(s) ��H<0������
��ͬ��ȳ���A��B���ﵽƽ��ʱ������A��BŨ�ȱ仯
��ͼ�����ߣ�ʵ�ߣ���ʾ�������ж���ȷ����

A��T �� ʱ���÷�Ӧ��ƽ�ⳣ��ֵΪ4
B��c��û�дﵽƽ�⣬��ʱ��Ӧ���������
C����c��Ϊƽ��㣬���ʱ�����ڵ��¶ȸ���T ��
D��T��ʱ��ֱ��cd �ϵĵ��Ϊƽ��״̬
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ����������ɽ���и�һ�����л�ѧ�Ծ��������棩 ���ͣ������
ij������ȫ���ҵIJ���ҩ����Ҫ����NaN3��Fe2O3��KClO4��NaHCO3�����ʡ�������������ײʱ������ҩ��������������ʹ����Ѹ�����ͣ��Ӷ��������á�
��1��NaN3�����巢���������ȷֽ����N2��Na��N2�ĵ���ʽΪ
��2��Fe2O3��������������Na��Ӧ���ɵĻ�ԭ����Ϊ ����֪�÷�ӦΪ�û���Ӧ).
��3��KClO4��������������Ӧ��������Na��������KCl��Na2O��KClO4���л�ѧ��������Ϊ ��KCl������ʱ����ɫΪ ɫ��
��4��NaHCO3����ȴ�������ղ����������ͷŵ������������ֽ⣬�仯ѧ����ʽΪ ��
��5��100g��������ҩ������������ͨ����ʯ�Һ�õ�N2 33.6L����״������
���ü�ʯ�ҳ�ȥ������Ϊ ��
�ڸò���ҩ����NaN3����������Ϊ ����4�֣�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ����������ɽ���и�һ�����л�ѧ�Ծ��������棩 ���ͣ�ѡ����
���е���ʽ��д����ȷ����
A��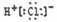 B��
B��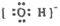 C��
C��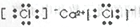 D��
D��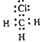
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016������ʡ�����������Ӧ�Կ������ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
25�棬��ijһԪ��MOH�������������(����仯���Բ���)����÷�Ӧ����Һ��pH���±����������жϲ���ȷ����
ʵ���� | c(����)/(mol��L-1) | c(MOH)/(mol��L-1) | ��Ӧ����Һ��pH |
�� | 0.20 | 0.20 | 5 |
�� | 0.10 | a | 7 |
A��a>0.10
B��ʵ���������Һ��c(Cl-)>c(M+)>c(H+)>c(MOH)
C����ʵ�����������Һ��ˮϡ�ͺ�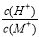 ��С
��С
D��MOH�ĵ���ƽ�ⳣ�����Ա�ʾΪ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com